แบบจำลองอะตอม ตอนที่ 15 เลขควอนตัม (Quantum number)
เลขควอนตัม (Quantum number)
แบบจำลองอะตอมของโบร์ ใช้ได้ดีกับอะตอมไฮโดรเจนหรือไอออนที่มีอิเล็กตรอนเพียงตัวเดียวเท่านั้น คืออธิบายได้ว่าเส้นสเปกตรัมแต่ละเส้นเกิดขึ้นได้อย่างไร
แต่สำหรับอะตอม ที่มีอิเล็กตรอนมากกว่า 1 ซึ่งทำให้มีเส้นสเปกตรัมแปลกไปกว่ากรณีของไฮโดรเจน พบว่าแบบจำลองอะตอมของโบร์ไม่สามารถอธิบายการเกิดเส้น
สเปกตรัมเหล่านั้นได้
ความแตกต่างนี้ต้องอธิบายด้วยกลศาสตร์ควอนตัม (quantum mechanics) ซึงค้นพบโดย ชเรอดิงเงอร์ โดยพบว่าอิเล็กตรอนมีสมบัติเป็นคลื่น
(อิเล็กตรอนเป็นไปได้ 2 แบบ คือเป็นวัตถุ มีมวล 9.1 x 10-28 กรัม ดังที่กล่าวมาในตอนแรก กับอีกแบบหนึ่งมีสมบัติเป็นคลื่นตามที่ชเรอดิงเงอร์พบ) เป็นที่มาของเลขควอนตัม
(quantum number) คือตัวเลขที่ใช้แสดงสมบัติของอิเล็กตรอนแต่ละตัว ที่อยู่ในออร์บิทัลต่าง ๆ โดยอิเล็กตรอนแต่ละตัวจะแสดงสมบัติด้วยเลขควอนตัม 1 ชุด ประกอบด้วย
ตัวเลข 4 ค่า คือ n , l , ml , mS
1. เลขควอนตัมหลัก (principle quantum number , n ) บอกให้ทราบถึงระดับพลังงาน (shell) ของอิเล็กตรอนโดยมีค่าตั้งแต่
n=1 n=2 n=3 n=4 n=5 n=6 และ n=7 …
(คลิ้กชม เลขควอนตัมหลัก)
2. เลขควอนตัมโมเมนตัมเชิงมุม (angular momentum quantum number, l ) บางครั้งเรียกว่าควันตัมออร์บิทัล (orbital quantum number)
หรือเรียกว่า Azimuthal quantum number (คลิ้ก) ตัวเลขนี้จะบอกให้ทราบถึงจำนวนและชนิดของระดับพลังงานย่อย (subshell) ทำให้ทราบว่ามีออร์บิทัลทั้งหมดกี่ออร์บิทัล
เมื่อทราบจำนวนออร์บิทัลจะทราบว่าแต่ละออร์บิทัลทำมุมกันเท่าไร จึงทราบว่ารูปร่างของกลุ่มออร์บิทัลเป็นแบบใด ค่า l ของแต่ละระดับพลังงาน ,shell ( n )
จะเริ่มจาก 0 สิ้นสุดที่ n-1 หรือเขียนในรูปสมการว่า ; l = 0 ถึง n – 1
ค่า l เป็นตัวเลขที่ใช้บอกชนิดของ subshell ดังนี้
l = 0 หมายถึง subshell s (มีอิเล็กตรอนได้ 2 ตัว มี 1 ออร์บิทัล รูปร่างเป็นทรงกลม)

Subshell s มีอยู่ทุกระดับพลังงาน (shell) ตั้งแต่ n = 1 ถึง n = 7 ฉะนั้น subshell s จึงมีตั้งแต่ 1s 2s 3s 4s 5s 6s และ 7s มีรูปร่างเป็นทรงกลมเหมือนกัน
แต่มีขนาดใหญ่ขึ้นตามลำดับ หุ้มซ้อนกันเป็นชั้น ๆ
l = 1 หมายถึง subshell p (มีอิเล็กตรอนได้ 6 ตัว มี 3 ออร์บิทัล แต่ละออร์บิทัลรูปร่างคล้าย ดัมเบลล์)
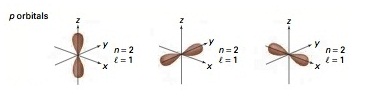
Subshell p เริ่มมีที่ระดับพลังงาน n = 2 ฉะนั้น subshell p จึงประกอบด้วย 2p , 3p , 4p , 5p , 6p , 7p … มีรูปร่างคล้ายดัมเบลล์เช่นเดียวกัน
แต่มีขนาดใหญ่ขึ้นตามลำดับซ้อน ๆ กันออกไปตามแนวเดียวกัน
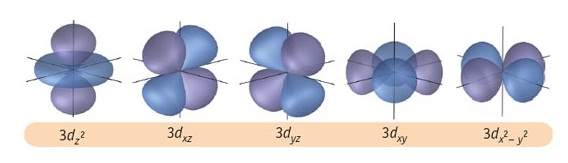
l = 2 หมายถึง subshell d (มีอิเล็กตรอนได้ 10 ตัว มี 5 ออร์บิทัล แต่ละออร์บิทัลรูปร่างคล้ายดัมเบลล์ไขว้กัน)
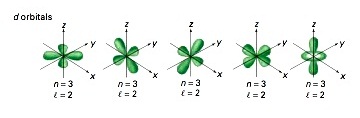
Subshell d เริ่มมีที่ระดับพลังงาน n = 3 ฉะนั้น subshell d จึงประกอบด้วย 3d , 4d , 5d , 6d , 7d … มีรูปร่างคล้ายดัมเบลล์เช่นเดียวกัน
แต่มีขนาดใหญ่ขึ้นตามลำดับซ้อน ๆ กันออกไปตามแนวเดียวกัน
l = 3 หมายถึง subshell f (มีอิเล็กตรอนได้ 14 ตัว มี 7 ออร์บิทัล แต่ละออร์บิทัลรูปร่างคล้ายดัมเบลล์ไขว้กันแบบซับซ้อนมาก)
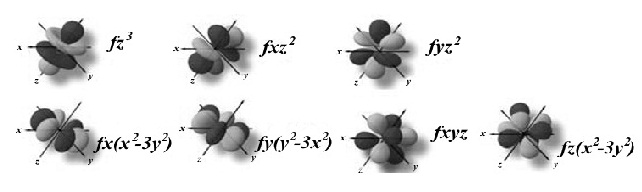
l = 4 หมายถึง subshell g เริ่มที่ n = 5 (มีอิเล็กตรอนได้ 18 ตัว) * ปัจจุบันยังไม่พบ
l = 5 หมายถึง subshell h เริ่มที่ n = 6 (มีอิเล็กตรอนได้ 22 ตัว) * ปัจจุบันยังไม่พบ
l = 6 หมายถึง subshell i เริ่มที่ n = 7 (มีอิเล็กตรอนได้ 26 ตัว) * ปัจจุบันยังไม่พบ
3. เลขควอนตัมแม่เหล็ก (magnetic quantum number, ml , m ) บอกสมบัติในการจัดทิศทางของออร์บิทัลเมื่ออยู่ในสนามแม่เหล็กค่าของ ml อาจเป็นลบ ( - )
หรือ ศูนย์ หรือเป็นบวก (+) ก็ได้ โดยทั่วไปจะเขียนว่ามีค่าอยู่ระหว่าง -1 , 0 , + 1 หรือจะเขียนกลับกันเป็น +1 , 0 , -1 ก็ได้ แต่ต้องทำให้เหมือนกันทั้งชุด
(The magnetic quantum number denotes the energy levels available within a subshell.)
จำนวนค่าของ ml = (2l + 1) ค่า ให้สังเกตให้ดีว่า จำนวนค่าของ ml กับค่าของ ml ไม่ใช่สิ่งเดียวกันคือจำนวนค่าของ ml คิดมาจาก 2l + 1
เช่น ถ้า l คือ 1 จำนวนค่าของ ml = 2(1) + 1 = 3 ค่า แต่ค่าของมันคือ -1 , 0 , +1
ตารางแสดงค่า l จำนวนค่าของ ml และค่าของ ml
|
l
|
จำนวนค่าของ ml
|
ค่าของ ml
|
|
0
|
1 ค่า
|
0
|
|
1
|
3 ค่า
|
-1,0,+1
หรือ +1,0,-1
|
|
2
|
5 ค่า
|
-2,-1,0,+1,+2
หรือ +2,+1,0,-1,-2
|
|
3
|
7 ค่า
|
-3,-2,-1,0,+1,+2,+3
หรือ +3,+2,+1,0,-1,-2,-3
|
|
4
|
9 ค่า
|
-4,-3,-2,-1,0,+1,+2,+3,+4
หรือ +4,+3,+2,+1,0,-1,-2,-3,-4
|
4. เลขควอนตัมสปิน (spin quantum number, mss) เป็นการบอกลักษณะการหมุนรอบตัวเองของอิเล็กตรอน มี 2 ค่าได้แก่ +1/2 แทนการหมุนรอบตัวเอง
แบบตามเข็มนาฬิกา และ -1/2 แทนการหมุนรอบตัวเองแบบทวนเข็มนาฬิกา
( the spin quantum number describe the unique quantum state of an electron and is designated by the letter s.)
ตารางแสดงเลขควอนตัม n l ml และความหมาย
|
n
|
l
|
ml
|
จำนวน
ออร์บิทัล
|
ชื่อออร์บิทัล
หรือ subshell
|
จำนวนอิเล็กตรอน
ที่มีได้ทั้งหมด
|
|
1
|
0
|
0
|
1
|
1s
|
2
|
|
2
|
0
|
0
|
1
|
2s
|
2
|
|
1
|
-1, 0, +1
|
3
|
2p
|
6
|
|
3
|
0
|
0
|
1
|
3s
|
2
|
|
1
|
-1, 0, +1
|
3
|
3p
|
6
|
|
2
|
-2, -1, 0, +1, +2
|
5
|
3d
|
10
|
|
4
|
0
|
0
|
1
|
4s
|
2
|
|
1
|
-1, 0, +1
|
3
|
4p
|
6
|
|
2
|
-2, -1, 0, +1, +2
|
5
|
4d
|
10
|
|
3
|
-3, -2, -1, 0, +1, +2, +3
|
7
|
4f
|
14
|
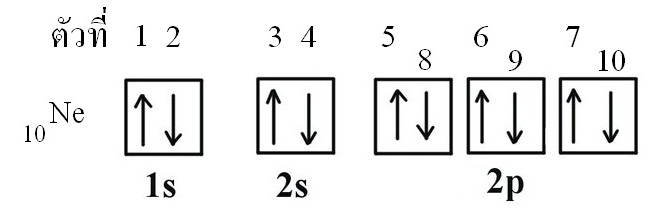
ตัวอย่างเลขควอนตัม n l ml ของอิเล็กตรอนแต่ละตัวของ 10Ne (มีอิเล็กตรอน 10 ตัว)
|
n
|
l = 0 ถึง (n-1)
|
จำนวน ml
( = 2l + 1) ค่า
|
เป็นของอิเล็กตรอนตัวที่
|
|
1
|
0
|
มี 1 ค่าคือ 0
|
1,2
|
|
2
|
0
|
มี 1 ค่าคือ 0
|
3,4
|
|
1
|
มี 3 ค่าคือ -1,0,+1
|
5,6,7,8,9,10
|
เลขควอนตัม n l ml ms ของอิเล็กตรอนแต่ละตัวของ 10Ne (มีอิเล็กตรอน 10 ตัว)
|
e- ตัวที่
|
n
|
l
|
ml
|
ms
|
อยู่ใน orbital
|
|
1
|
1
|
0
|
0
|
+1/2
|
1s
|
|
2
|
1
|
0
|
0
|
-1/2
|
|
3
|
2
|
0
|
0
|
+1/2
|
2s
|
|
4
|
2
|
0
|
0
|
-1/2
|
|
5
|
2
|
1
|
-1
|
+1/2
|
2px
|
|
6
|
2
|
1
|
0
|
+1/2
|
2py
|
|
7
|
2
|
1
|
+1
|
+1/2
|
2pz
|
|
8
|
2
|
1
|
-1
|
-1/2
|
2px
|
|
9
|
2
|
1
|
0
|
-1/2
|
2py
|
|
10
|
2
|
1
|
+1
|
-1/2
|
2pz
|
อิเล็กตรอนทั้ง 10 ตัวของนีออน เมื่อดูในแผนผังออร์บิทัลจะเป็นดังนี้
(คลิ้ก ชมเลขควอนตัมของ Si)
(เรียนเรื่องเลขควอนตัมกับครูฝรั่ง)
(อ่านเพิ่มเติม คลิกที่นี่)
(คลิ้ก ทำแบบฝึกหัดเลขควอนตัม)
สมบัติทางแม่เหล็กของสาร
โดยทั่วไปแม่เหล็กแบ่งได้เป็น 2 ชนิดคือ แม่เหล็กถาวร (permanent magnetic) กับแม่เหล็กชั่วคราว (temporary magnetic) โดยแม่เหล็กถาวรคือ
แม่เหล็กที่เมื่อเกิดสมบัติแม่เหล็กแล้วไม่สูญเสียสภาพแม่เหล็กโดยง่าย เช่น แม่เหล็กที่ทำจากเหล็กกล้า ส่วนแม่เหล็กชั่วคราวคือ แม่เหล็กที่เมื่อมีสมบัติแม่เหล็กแล้ว
สามารถสูญเสียสภาพความเป็นแม่เหล็กได้ง่าย เช่น แม่เหล็กที่ทำจากเหล็กอ่อน เป็นต้น
นอกจากเหล็กแล้ว วัสดุอื่นๆ เช่น นิกเกิล โคบอลต์ รวมถึงโลหะผสมของธาตุแรร์เอิทท์ (rare earth) บางชนิด (แรร์เอิร์ท คือธาตุในกลุ่มแอกทิไนด์
และกลุ่มแลนทาไนด์ เป็นธาตุหายาก ) ก็สามารถกระตุ้นหรือเหนี่ยวนำให้เกิดสมบัติแม่เหล็กได้เช่นกัน นักวิทยาศาสตร์เรียกกลุ่มวัสดุที่สามารถกระตุ้นให้กลายเป็นแม่เหล็กได้ว่า
เฟอร์โรแมกนีติก (ferromagnetic) และแบ่งเป็น 2 ประเภท คือ เฟอร์โรแมกนีติกแบบอ่อน (soft) ซึ่งเป็นวัสดุที่ถูกกระตุ้นแล้วได้แม่เหล็กชั่วคราว กับเฟอร์โรแมกนีติกแบบเข้ม
(hard) ซึ่งเมื่อกระตุ้นแล้วกลายเป็นแม่เหล็กถาวร
สมบัติแม่เหล็กสามารถแบ่งได้เป็น 3 ประเภท คือ
1. สารเฟอโรแมกเนติก (Ferromagnetic Material) เป็นสารที่มีสมบัติเป็นแม่เหล็กอยู่ในตัวอย่างถาวร แม้ไม่ได้อยู่ในสนามไฟฟ้าหรือสนามแม่เหล็ก
ก็ยังคงแสดงสมบัตเป็นแม่เหล็ก จึงดูดเหล็กและแม่เหล็กก้อนอื่นได้ ได้แก่ เหล็ก โคบอลต์ นิกเกิล เป็นต้น
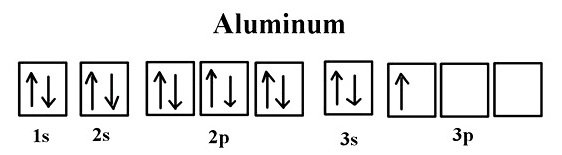
2. สารพาราแมกเนติก (Paramagnetic Material) เป็นสารที่มีสมบัติเป็นแม่เหล็กอยู่ในตัวแต่ไม่ถาวรถ้าอยู่ในสนามแม่เหล็กหรือสนามไฟฟ้าจึงจะ
แสดงความเป็นแม่เหล็ก หรือเรียกว่าเหนี่ยวนำให้เป็นแม่เหล็กได้ แต่เมื่อออกจากสนามแม่เหล็กหรือสนามไฟฟ้าความเป็นแม่เหล็กก็จะหมดไป เกิดจากการมีอิเล็กตรอนเดี่ยว
อยู่ในออร์บิทัล ยิ่งมีอิเล็กตรอนเดี่ยวมากก็จะยิ่งเหนี่ยวนำให้เป็นแม่เหล็กได้มากขึ้น เช่น เช่น อะลูมินัม โครเมียม โมลิบดีนัม โซเดียม ไทเทเนียม เซอร์โคเนียม
(คลิ้กเพื่อชมเพิ่มเติม)
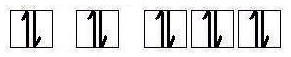
3. สารไดอะแมกเนติก (Diamagnetic Material) เป็นสารที่ไม่มีสมบัติของแม่เหล็กอยู่ในตัว เหนี่ยวนำให้เป็นแม่เหล็กไม่ได้ แต่อาจมีแรงผลักแม่เหล็ก
อย่างอ่อน ๆ เกิดจากไม่มีอิเล็กตรอนเดี่ยวอยู่ในออร์บิทัล เช่น ธาตุนีออน (10Ne) มีการจัดเรียงอิเล็กตรอนเป็น 1s2 2s2 2p6
(คลิ้กเพื่อชมเพิ่มเติม)
แบบจำลองอะตอมของชเรอดิงเงอร์ (Quantum model)
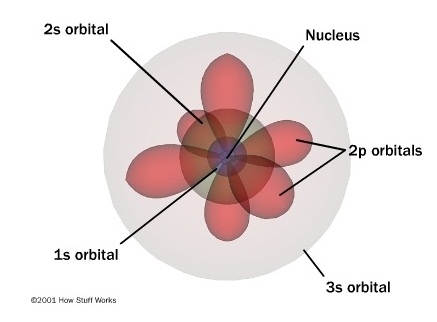
แบบจำลองอะตอมชนิดกลุ่มหมอกอิเล็กตรอนยังคงเป็นที่ยอมรับ แต่มีการพัฒนารูปแบบไปจากเดิมที่เสนอว่ากลุ่มหมอกเป็นรูปทรงกลม จากการค้นพบของชเรอดิงเงอร์
ทำให้ทราบว่าอิเล็กตรอนในออร์บิทัลต่าง ๆ จะเคลื่อนที่อยู่ในพื้นที่เฉพาะทำให้เกิดรูปร่างของออร์บิทัล ฉะนั้นกลุ่มหมอกของอิเล็กตรอนจึงไม่เป็นทรงกลมเสมอไป แต่มีรูปร่างเป็นอย่างอื่น
ตามชนิดของออร์บิทัลด้วย ดังรูป
(คลิ้ก ชมแบบจำลองอะตอมของชเรอดิงเงอร์)
แบบฝึกหัด
1. จงเติมข้อมูลเกี่ยวกับเลขควอนตัมในช่องว่างของตารางต่อไปนี้
2. จงหาว่า n, l และ ml มีอะไรบ้างเมื่อ subshell เป็น 4d
3. จงเขียนเลขควอนตัมทั้ง 4 ค่าของอิเล็กตรอนทั้งหมดใน orbital 3p
|
e- ตัวที่
|
n
|
l
|
ml
|
ms
|
|
1
|
|
|
|
|
|
2
|
|
|
|
|
|
3
|
|
|
|
|
|
4
|
|
|
|
|
|
5
|
|
|
|
|
|
6
|
|
|
|
|
4. ธาตุที่มีการจัดอิเล็กตรอนใน orbital ดังนี้ 1s2, 2s2, 2p6, 3s2, 3p3 จงทำนายว่าอะตอมนี้คือธาตุอะไร และให้เขียนเลขควอนตัมทั้ง 4 ค่าของอิเล็กตรอนใน 3s
ตอบ ธาตุนี้คือ...........................................
5. ให้เขียนเลขควอนตัมทั้ง 4 ค่าของอิเล็กตรอนทั้ง 8 ของอะตอมออกซิเจน (แนะนำ : ต้องเรียงตามลำดับพลังงานของ subshell ก่อน)
|
e- ตัวที่
|
n
|
l
|
ml
|
ms
|
|
1
|
|
|
|
|
|
2
|
|
|
|
|
|
3
|
|
|
|
|
|
4
|
|
|
|
|
|
5
|
|
|
|
|
|
6
|
|
|
|
|
|
7
|
|
|
|
|
|
8
|
|
|
|
|
6. จงแสดงเหตุผลว่าธาตุต่อไปนี้ เป็น diamagnetic หรือ paramagnetic ; 17Cl, 18Ar, 54Xe, 49In, 38Sr, 5B, 6C
……………………………………………………………………………………………………………………………………………………………………………………………………
5. จงระบุเลขควอนตัมของอิเล็กตรอนใน 5p ออร์บิทัล
|
e- ตัวที่
|
n
|
l
|
ml
|
ms
|
|
1
|
|
|
|
|
|
2
|
|
|
|
|
|
3
|
|
|
|
|
|
4
|
|
|
|
|
|
5
|
|
|
|
|
|
6
|
|
|
|
|
6. จงอธิบายโดยใช้ความรู้เรื่องโครงแบบอิเล็กตรอนและระดับพลังงานออร์บิทัลของอะตอมว่าทำไมออกซิเจนจึงเกิดเป็นไอออนสองลบ (O2- ) ได้ง่าย ในขณะที่ Na
จะเกิดไอออนหนึ่งบวก (Na+ ) ได้ง่าย
……………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………….
7. ระบุว่าธาตุหรือไอออนต่อไปนี้อยู่ในหมู่และคาบใดของตารางธาตุ และแสดงการจัดอิเล็กตรอน (Electron
Configuration) พร้อมแผนภาพแสดงการเติมอิเล็กตรอน (ใช้ ↑ แทนออร์บิทัล และ หรือ แทนอิเล็กตรอน) และพิจารณาว่าจัดไว้ในหมู่ / คาบ ใด
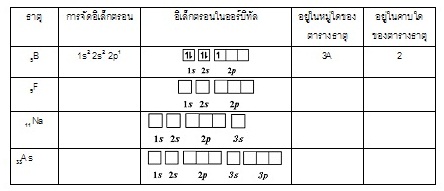
Appendix
1. Four electrons in an atom have the quantum number given below. Which electron is at the highest energy? (Ans.d) (อิเล็กตรอน 4 ตัว
ซึ่งมีเลขควอนตัมดังที่กำหนด จงพิจารณาว่าตัวใดมีพลังงานสูงสุด)
a) n = 4, l = 0, ml = 0, ms = +1/2
b) n = 3, l = 0, ml = 0, ms = -1/2
c) n = 3, l = 2, ml = 0, ms = +1/2
d) n = 4, l = 1, ml = -1, ms = -1/2
2. The set of quantum numbers, n = 2, l = 2, ml = 0 ; what this meam. (Ans.d) (เลขควอนตัมชุดนี้มีความหมายอย่างไร)
a) describes an electron in a 2d orbital (บอกให้ทราบว่าอิเล็กตรอนอยู่ในออร์บิทัล 2d)
b) describes one of five orbitals of a similar type (บอกให้ทราบว่าเป็น 1 ใน 5 ของออร์บิทัลที่มีสมบัติ เหมือนกัน)
c) describes an electron in a 2p orbital (บอกให้ทราบว่าอิเล็กตรอนอยู่ในออร์บิทัล 2p)
d) is not allowed (ไม่มีข้อใดถูกเลย)
3. The set of quantum numbers, n = 3, l = 2, ml = 0 ; what this meam. (Ans.d) (เลขควอนตัมชุดนี้มีความหมายอย่างไร)
a) describes an electron in a 2d orbital (บอกให้ทราบว่าอิเล็กตรอนอยู่ในออร์บิทัล 2d)
b) is not allowed(ไม่มีข้อใดถูกเลย)
c) describes an electron in a 3p orbital (บอกให้ทราบว่าอิเล็กตรอนอยู่ในออร์บิทัล 3p)
d) describes one of five orbitals of a similar type (บอกให้ทราบว่าเป็น 1 ใน 5 ของออร์บิทัลที่มีสมบัติเหมือนกัน)
4. The set of quantum numbers, n = 4, l = 3, ml = 2 ; what this meam. (Ans.d); (เลขควอนตัมชุดนี้มีความหมายอย่างไร)
a) is not allowed (ไม่มีข้อถูก)
b) describes an electron in a 4d orbital ; (บอกให้ทราบว่าเป็นอิเล็กตรอนที่อยู่ในออร์บิทัล 4d)
c) describes an electron in a 3p orbital ; ( บอกให้ทราบว่าเป็นอิเล็กตรอนที่อยู่ในออร์บิทัล 3p)
d) describes one of seven orbitals of a similar type ; (บอกให้ทราบว่าเป็น 1 ใน 7 ออร์บิทัลที่มัสมบัตคล้ายกัน)
5. Four electrons in an atom have the quantum number given below. Which electron is at the highest energy? ; (Ans.d) ; (อิเล็กตรอน 4 ตัวของอะตอมหนึ่ง
แต่ละตัวมีเลขควอนตัมดังที่กำหนดในแต่ละข้อ อยากทราบว่าตัวไหนมีพลังงานสูงสุด)
a) n = 3, l = 0, ml = 0, ms = -1/2 b) n = 4, l = 0, ml = 0, ms = +1/2
c) n = 3, l = 2, ml = 0, ms = +1/2 d) n = 4, l = 1, ml = -1, ms = -1/2
6. Which of the following statements is correct for an electron that has the quantum numbers n = 4 and
ml = 2? ; (Ans.d) (ข้อใดกล่าวถึงสมบัติของอิเล็กตรอนซึ่งมีเลขควอนตัม n=4 และ ml = -2 ได้ถูกต้อง)
a) none of the above applies to this electron (ไม่มีข้อใดถูก)
b) the electron may be in a p orbital (อิเล็กตรอนตัวนี้อยู่ใน p orbital)
รูปภาพที่เกี่ยวข้อง

Size : 19.33 KBs
Upload : 2012-11-02 19:46:14
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|