ตารางธาตุ ตอนที่ 1
ตารางธาตุ (Periodic table)
ภายหลังจากการเกิดบิกแบงสสาร
(สาร) เคลื่อนที่กระจายออกไปทุกทิศทางโดยรอบ
จากนั้นแรงโน้มถ่วงจึงดึงดูดสสารเข้าหากัน
สสารที่มีมวลมากจะมีแรงโน้มถ่วงมาก
แรงโน้มถ่วงทำให้วัตถุอยู่รวมกันได้
ในขณะนั้นมีไฮโดรเจนและฮีเลียมเกิดขึ้นก่อนจึงยึดเหนี่ยวกันเป็นกาแล็กซี แล้วกลุ่มแก๊สขนาดเล็กที่อยู่ในกาแลกซีรวมตัวกันเป็นดาวฤกษ์จำนวนมาก กาแล็กซีในช่วงแรกจะมีขนาดเล็กและมีรูปร่างต่าง
ๆ กัน
แต่ในที่สุดก็จกลายเป็นกาแล็กซีแบบสไปรัล หรือกาแลกซีรูปไข่อย่างที่เป็นอยู่ในปัจจุบัน (คลิ้กชมภาพกาแลกซีแบบสไปรัล) ภายในกาแล็กซีต่าง
ๆ ยังมีดาวฤกษ์เกิดขึ้นอยู่เรื่อย ๆ ตัวกาแล็กซีเองก็อาจชนกันหรือรวมกันได้
ระบบสุริยะของเราซึ่งมีดวงอาทิตย์เป็นศูนย์กลาง อยู่ในกาแล็กซีทางช้างเผือก (milky way
galaxy) ซึ่งยังมีดาวฤกษ์อื่น ๆ เป็นจำนวนมากอยู่ด้วย และมีดาวฤกษ์ที่กำลังเกิดใหม่อยู่ด้วยเช่นกัน
นอกจากนั้นยังพบว่ากาแลกซีทางช้างเผือกกำลังดึงดูดกาแล็กซีเล็กๆ ที่อยู่ข้างเคียงเข้ามาอยู่ตลอดเวลา (คลิ้กชมภาพกาแลกซีทางช้างเผือก) (คลิ้ก
ชมวีดีทัศน์ The history of the universe in 10 minutes)
เมื่อดูทั้งเอกภพจะพบว่าเกือบทั้งหมดเป็นธาตุไฮโดรเจน ธาตุอื่น ๆ ที่มีมวลอะตอมมากขึ้นจะเกิดขึ้นในภายหลัง ในเอกภพมีไฮโดรเจน 75% ฮีเลียม 24% และอีก 1% เป็นโลหะ
แต่สำหรับโลกของเรา ธาตุที่มีมากที่สุดในเปลือกโลกคือออกซิเจน
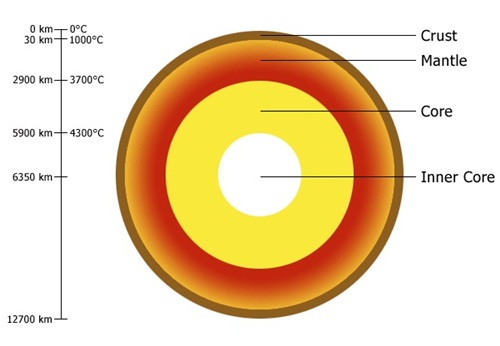
โครงสร้างของโลก
แบ่งเป็น 3 ชั้น คือ เปลือกโลก แมนเทิล(เนื้อโลก) และแกนโลก
1. เปลือกโลก (crust)
มีความหนา 6-35 กิโลเมตร คือส่วนที่อยู่ชั้นนอกสุดของโลก เป็นชั้นของโลกที่บางที่สุด แต่มีความสำคัญมากที่สุด
เนื่องจากสิ่งมีชีวิตอาศัยอยู่ที่ชั้นนี้
เป็นส่วนของพื้นดินที่ใช้ในการเพาะปลูก เป็นแหล่งน้ำ ซึ่งจำเป็นต่อมนุษย์ เป็นแหล่งที่ให้แร่ธาตุต่าง ๆ เช่น น้ำมัน ถ่านหิน
แก๊สธรรมชาติ และทรัพยากรอื่น ๆ
2. แมนเทิล
(mantle) หรือเนื้อโลกมีความหนาประมาณ
3,000 กิโลเมตร อยู่ถัดลงไปจากเปลือกโลก
ประกอบด้วยหินเหลวหนืด (แมกมา) อุณหภูมิ 800-
4,300 oC แมนเทิลประกอบด้วยธาตุซิลิคอน เหล็ก อลูมิเนียม บางส่วนเป็นของแข็ง
ในขณะที่บางส่วนหลอมเหลว
3. แก่นโลก (core) มีความหนาประมาณ 3,440 กิโลเมตร แบ่งเป็นแก่นโลกชั้นนอก
และแก่นโลกชั้นใน ธาตุซึ่งเป็นองค์ประกอบของแก่นโลกคือ ธาตุเหล็กและนิเกิล แก่นโลกชั้นนอก
เป็นของเหลวร้อนอุณหภูมิประมาณ 4,300-6,200
องศาเซลเซียส ความหนาแน่น 12
g/cm3 แก่นโลกชั้นใน เป็นของแข็ง อุณหภูมิ 6,200-6,400 องศาเซลเซียส
มีความหนาแน่นมากที่สุดประมาณ 17 g/cm3
(คลิ้ก ชมวีดีทัศน์ Structure
of the earth)
เปลือกโลกประกอบด้วยธาตุต่าง
ๆ เป็นจำนวนมาก (ประมาณ 100 ธาตุ) ส่วนมากอยู่ในรูปของสารประกอบ มีจำนวนน้อยที่เป็นธาตุบริสุทธิ์ ธาตุแต่ละธาตุมีปริมาณไม่เท่ากัน ธาตุที่มีปริมาณมาก 8
อันดับแรกในเปลือกโลกมีดังนี้
|
ธาตุ
|
สัญลักษณ์
|
ปริมาณร้อยละโดยน้ำหนัก
|
|
ออกซิเจน
|
O
|
44.6
|
|
ซิลิคอน
|
Si
|
27.7
|
|
อลูมิเนียม
|
Al
|
8.1
|
|
เหล็ก
|
Fe
|
5.0
|
|
แคลเซียม
|
Ca
|
3.6
|
|
โซเดียม
|
Na
|
2.8
|
|
โพแทสเซียม
|
K
|
2.6
|
|
แมกนีเซียม
|
Mg
|
2.1
|
วิวัฒนาการการสร้างตารางธาตุ
ค.ศ.
1850 (พ.ศ.2393) ขณะนั้นมีการค้นพบธาตุธาตุต่าง ๆ แล้ว ประมาณ
60 ธาตุ ดังนี้

ขณะนั้นยังไม่มีตารางธาตุ
แต่ก่อนหน้านั้นก็มีผู้พยายามหาวิธีจัดระเบียบของธาตุให้เป็นหมวดหมู่กันมาตลอด แต่ไม่ประสบผลสำเร็จเท่าที่ควร จนกระทั่ง เมนเดเลเอฟ (Mendeleev) และไมเออร์ ได้ตั้งข้อสังเกตอย่างเดียวกันในเวลาใกล้เคียงกันว่า ถ้าเรียงธาตุตามลำดับของมวลอะตอมจากน้อยไปมาก
จะพบว่าธาตุมีสมบัติคล้ายกันเป็นช่วง ๆ การที่ธาตุต่าง ๆ มีสมบัติคล้ายกันเป็นช่วง ๆ เช่นนี้ เมนเดเลเอฟ
ตั้งเป็นกฎเรียกว่า “กฎพีริออดิก” (periodic law ;
periodic แปลว่า เป็นระยะ) และได้เผยแพร่ความคิดนี้ในปี พ.ศ. 2412 (ค.ศ.1869) (ตรงกับสมัยต้นรัชกาลที่
5 ของไทย พ.ศ. 2411-2453) ในปีถัดมาไมเออร์ได้พิมพ์เผยแพร่ผลงาน โดยให้เกียรติแก่เมนเดเลเอฟ ด้วยการเรียกว่า
ตารางพีริออดิกของเมนเดเลเอฟ
เมนเดเลเอฟได้จัดธาตุที่มีสมบัติคล้ายกันที่ปรากฏซ้ำกันเป็นช่วง
ๆ ให้อยู่ในแนวดิ่ง
หรือในหมู่เดียวกันและพยายามเรียงลำดับมวลอะตอมของธาตุจากน้อยไปมาก ถ้าพบว่าช่วงไหนสมบัติไม่สอดคล้องกัน
จะเว้นช่องว่างเอาไว้ก่อน ซึ่งเขาคิดว่าช่องว่างเหล่านั้นน่าจะเป็นตำแหน่งของธาตุที่ยังค้นไม่พบ ตำแหน่งของธาตุในตารางธาตุมีความสัมพันธ์กับสมบัติของธาตุ เมนเดเลเอฟทำนายสมบัติของธาตุในช่องว่างที่ยังไม่ค้นพบเอาไว้ 3
ธาตุ คือตำแหน่งใต้ธาตุโบรอน ตั้งชื่อเอาไว้ว่าเอคา โบรอน ตำแหน่งใต้ธาตุอลูมิเนียม ตั้งชื่อว่า เอคา อลูมิเนียม และตำแหน่งใต้ซิลิคอน ตั้งชื่อว่าเอคา ซิลิคอน จากนั้นอีก 15 ปีต่อมา
วิงค์เลอร์จึงค้นพบธาตุที่อยู่ในตำแหน่งใต้ซิลิคอน ซึ่งก็คือธาตุเจอร์เมเนียม (Ge) ในปัจจุบัน
พบว่าสมบัติของเจอร์มาเนียมที่ค้นพบกับสมบัติที่เมนเดเลเอฟทำนายเอาไว้ล่วงหน้าใกล้เคียงกันมาก สำหรับธาตุเอคา โบรอน ปัจจุบันคือสแกนเดียม เป็นโลหะแทรนซิชัน การทำนายคลาดเคลื่อนไปเล็กน้อย ส่วนธาตุเอคา อลูมิเนียม ปัจจุบันคือ Ga การทำนายเป็นไออย่างถูกต้องเช่นกัน
การเรียงธาตุตามมวลอะตอมในตารางพีริออดิกของเมนเดเลเอฟนั้น
ถ้ายึดหลักการเรียงตามมวลอะตอมโดยเคร่งครัด
จะพบจุดบกพร่องในบางช่วงคือทำให้ธาตุบางธาตุอยู่ในหมู่เดียวกันมี สมบัติแตกต่างกัน
ต้องมีการสลับที่โดยจัดให้ธาตุที่มีมวลอะตอมมากกว่าให้อยู่ข้างหน้า เช่น ต้องสลับที่ระหว่าง 40Ar กับ 39K โดยให้ Ar ซึ่งมีมวลอะตอมมากกว่ามาอยู่หน้า K แต่เมนเดเล เอฟไม่สามารถอธิบายได้ว่าเป็นเพราะเหตุใด
เนื่องจากในสมัยนั้นยังไม่เข้าใจเรื่องโครงสร้างของอะตอมและไอโซโทป นักวิทยาศาสตร์รุ่นต่อมาเกิดแนวความคิดว่า
สมบัติของธาตุไม่น่าจะขึ้นอยู่ กับมวลอะตอมของธาตุ
แต่น่าจะขึ้นอยู่กับสมบัติอื่นที่มีความสัมพันธ์กับมวลอะตอม (ปัจจุบันจัดเรียงธาตุในตารางธาตุตามเลขเชิงอะตอม) ตารางธาตุของเมนเดเลเอฟเป็นดังนี้
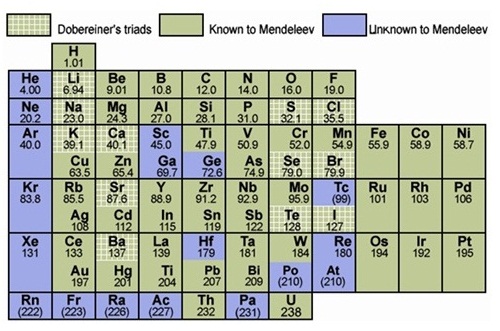
เฮนรี โมสลีย์ เป็นผู้พบว่าการเรียงธาตุตามลำดับเลขเชิงอะตอม หรือจำนวนโปรตอน
จะทำให้ความสัมพันธ์ระหว่างสมบัติของธาตุกับตำแหน่งในตารางธาตุ เป็นระบบและแน่นอนกว่าการจัดเรียงตามมวลอะตอมแบบเดิม
(มาทราบในภายหลังว่าสมบัติของธาตุขึ้นอยู่กับการจัดอิเล็กตรอนในอะตอมของธาตุนั้น
ๆ) การจัดเรียงธาตุตามเลขเชิงอะตอมใช้เป็นแบบแผนของตารางธาตุในปัจจุบัน จำแนกธาตุออกเป็นหมวดหมู่ ดังแสดงในเค้าโครงของตารางธาตุดังต่อไปนี้
ตารางธาตุปัจจุบัน
จากการค้นพบของเมนเดเลเอฟ
ไมเออร์ และเฮนรี
โมสลีย์ ทำให้มีการพัฒนาและปรับปรุงตารางธาตุมาอย่างต่อเนื่อง จนได้ตารางธาตุดังที่ใช้อยู่ในปัจจุบัน การจัดธาตุในตารางธาตุมีการจำแนกออกเป็นหมวดหมู่ตามสมบัติของธาตุ ดังนี้

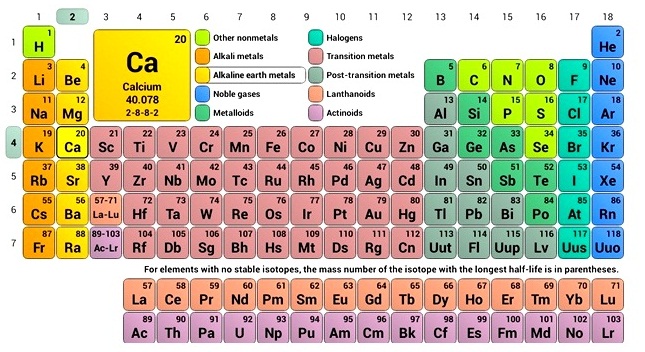
(คลิ้กเปิดตารางธาตุ)
ตารางธาตุในปัจจุบัน มีจำนวนแถวในแนวดิ่ง 18 แถว
เรียกว่าหมู่ (group) แบ่งออกเป็น 2
หมู่หลักคือหมู่
A และหมู่ B
ธาตุหมู่ A เป็นธาตุธรรมดา เรียกรวม ๆ
ว่า representative elements ประกอบด้วยโลหะ กึ่งโลหะและอโลหะ แบ่งออกเป็น 8 หมู่ย่อยคือ 1A
2A 3A 4A 5A 6A 7A และ 8A
บรรดาธาตุหมู่ A นั้น ธาตุที่อยู่หมู่เดียวกันจะมีเวเลนซ์อิเล็กตรอนเท่ากัน จึงมีสมบัติทางเคมีคล้าย ๆ กัน จำนวนเวเลนซ์อิเล็กตรอนจะมีเท่ากับเลขที่หมู่ที่จัดธาตุนั้นไว้
สำหรับธาตุหมู่ B
เรียกรวม ๆ ว่าโลหะแทรนซิชัน (transition elements) ทุกธาตุเป็นโลหะ ไม่มีอโลหะและธาตุกึ่งโลหะอยู่ในธาตุหมู่ B มีการแบ่งออกเป็น 8 หมู่ย่อยเช่นกันคือ 1B ถึง 8B
แต่จำนวนเวเลนซ์อิเล็กตรอนของธาตุหมู่ B ไม่สัมพันธ์กับเลขที่หมู่ของธาตุ
ไม่ว่าจะอยู่หมู่ใดจะมีเวเนซ์อิเล็กตรอนไม่เกิน 2
ส่วนมากจะ = 2
จำนวนแถวตามแนวนอนเรียกว่าคาบ
(Period) ปัจจุบันมีทั้งหมด 7 คาบ ธาตุที่ถูกจัดเอาไว้ในคาบเดียวกันจะมีจำนวนระดับพลังงานของอิเล็กตรอนเท่ากัน จำนวนระดับพลังงานจะมีเท่ากับเลขที่ของคาบที่จัดธาตุนั้นไว้
ถ้าสังเกตจากตารางธาตุจะเห็นได้ว่า
ธาตุสุดท้ายของคาบที่ 7 มีเลขเชิงอะตอม 118
ฉะนั้นถ้ามีการค้นพบหรือสังเคราะห์ธาตุที่มีเลขเชิงอะตอม 119
ได้สำเร็จ
ตารางธาตุจะต้องเพิ่มคาบที่ 8 ขึ้นมาอีก
1 คาบ
ความสัมพันธ์ระหว่างการจัดอิเล็กตรอนกับตำแหน่งของธาตุในตารางธาตุ
ดังที่กล่าวในตอนต้นแล้วว่า ตารางธาตุปัจจุบันจัดตำแหน่งของธาตุตามสมบติของธาตุ ซึ่งสัมพันธ์กับการจัดอิเล็กตรอนของอะตอม จัดให้ธาตุที่มีจำนวนระดับพลังงานเท่ากันให้อยู่ในคาบเดียวกัน ถ้ามีจำนวนระดับพลังงาน 1 ระดับ จัดเอาไว้ในคาบที่ 1 ถ้ามีจำนวนระดับพลังงาน 2 3 4 5 6 7 ระดับ ก็จัดเอาไว้ในคาบที่ 2 3 4 5 6 7
ตามลำดับ
สำหรับธาตุหมู่ A จัดให้ธาตุที่มีจำนวนเวเลนซ์อิเล็กตรอนเท่ากันเอาไว้ในหมู่เดียวกัน ถ้ามีเวเลนซ์อิเล็กตรอน = 1 จะจัดไว้หมู่ 1A ถ้ามีเวเลนซ์อิเล็กตรอนเท่ากับ 2 3 4 5 6 7 8 จะจัดไว้ในหมู่ 2A 3A 4A 5A 6A 7A 8A ตามลำดับ (ยกเว้น He จัดไว้ในหมู่ 8A แต่มีเวเลนซ์อิเล็กตรอนเท่ากับ 2 )
ธาตุหมู่ B ไม่ว่าจะอยู่หมู่ใดก็จะมีเวเลนซ์อิเล็กตรอน 1 หรือ 2 เท่านั้น (ส่วนมาก = 2 ) ซึ่งเป็นลักษณะเฉพาะของธาตุที่เป็นโลหะ แต่อย่างไรก็ตามการมีเวเลนซ์อิเล็กตรอนเท่ากับ 1 หรือ 2 ของธาตุหมู่ B มีความแตกต่างจากโลหะหมู่ 1A หรือ 2A แม้ว่าจะมีเวเลนซ์อิเล็กตรอนเท่ากัน คือถ้าเป็นโลหะหมู่ 1A หรือ 2A จำนวนอิเล็กตรอนของชั้นที่ถัดจากเวเลนซ์อิเล็กตรอนเข้าไปจะเท่ากับ 8 แต่สำหรับธาตุหมู่ B จำนวนอิเล็กตรอนชั้นที่ถัดจากเวเลนซ์อิเล็กตรอนเข้าไปจะไม่เท่ากับ 8 และมีจำนวนไม่แน่นอนด้วย (อยู่ระหว่าง 9 ถึง 18) ดังตาราง
|
การจัดอิเล็กตรอน
ของธาตุหมู่ 1A
|
การจัดอิเล็กตรอน
ของธาตุหมู่ 2A
|
การจัดอิเล็กตรอน
ของธาตุหมู่ B คาบที่ 4
|
|
3 Li 2 1
11 Na 2 8 1
19 K 2
8 8 1
37 Rb 2 8
18 8 1
55 Cs 2
8 18 18 8 1
87 Fr 2 8
18 32 18 8 1
|
4 Be 2 2
12 Mg 2 8 2
20 Ca 2
8 8 2
38 Sr 2 8
18 8 2
56 Ba 2
8 18 18 8 2
88 Ra 2
8 18 32
18 8 2
|
21
Sc 2
8 9 2 ( หมู่ 3B )
22
Ti 2
8 10 2 ( หมู่ 4B )
23 V 2
8 11 2 ( หมู่ 5B )
24 Cr 2
8 13 1 ( หมู่ 6B )
25 Mn 2
8 13 2 ( หมู่
7B
)
26 Fe 2
8 14 2 (
หมู่ 8B )
27 Co 2
8 15 2 (
หมู่ 8B )
28
Ni 2
8 16 2 ( หมู่
8B
)
29
Cu 2
8 18 1 (
หมู่ 1B )
30 Zn 2
8 18 2 ( หมู่
2B )
|
สถานะของธาตุที่อุณหภูมิห้อง
เมื่อพิจารณาสถานะของธาตุ ณ อุณหภูมิห้อง ( 25 oC ) พบว่ามีทั้ง 3 สถานะ ได้แก่
1. ธาตุที่มีสถานะเป็นของเหลวที่อุณหภูมิห้อง ได้แก่ Br (จุดหลอมเหลว -7 oC) Hg (จุดหลอมเหลว -39 oC)
2. ธาตุที่มีสถานะเป็นแก๊ส ได้แก่ ธาตุหมู่ 8A คือ He Ne Ar Kr Xe Rn รวมทั้งธาตุที่เป็นอโลหะอีกจำนวนหนึ่งได้แก่ H N O F Cl
3. ธาตุที่มีสถานะเป็นของแข็ง ธาตุส่วนใหญ่เป็นโลหะ ยกเว้นที่กล่าวถึงในข้อ 1 และ 2
** ธาตุหมู่ 7A มีทั้ง 3 สถานะที่อุณหภูมิห้อง คือ F2 , Cl2 เป็นแก๊ส Br2 เป็นของเหลว I2 เป็นของแข็ง
(คลิ้กเปิดตารางธาตุ ดูสถานะของธาตุ)
ธาตุสังเคราะห์
ธาตุสังเคราะห์ที่ทำได้สำเร็จในปัจจุบันได้แก่ ได้แก่
61 โพรมีเทียม (61Pm) 93 เนปจูเนียม (93Np)
94 พลูโทเนียม (94Pu)
95 อเมริเซียม (95Am) 96 คูเรียม (96Cm) 97 เบอร์คีเลียม (97Bk)
98 แคลิฟอร์เนียม (98Cf) 99 ไอน์สไตเนียม (99Es) 100 เฟอร์เมียม (100Fm)
101 เมนเดลีเวียม (101Md) 102 โนเบเลียม (102No) 103 ลอเรนเซียม (103Lr)
104 รัทเทอร์ฟอร์เดียม (104Rf) 105 ดุบเนียม (105Db) 106 ซีบอร์เกียม (106Sg)
107 โบห์เรียม(107Bh) 108 ฮาสเซียม (108Hs) 109 ไมต์เนอเรียม (109Mt)
110 ดาร์มสแทดเทียม (110Ds) 111 เรินต์เกเนียม (111Rg) 112
โคเพนมิเวียม (112Cn) (ธาตุที่
113 ยังไม่พบ
ถ้าพบจะตั้งชื่อชั่วคราวว่า Ununtrium (113Uut)
114 คือ Flerovium (114Fl
)
116 คือ Livermorium (115 Lv )
- การอ่านชื่อธาตุที่มีเลขเชิงอะตอมมากกว่า 100 และยังไม่ค้นพบ ใช้วิธีระบุเลขเชิงอะตอมด้วยจำนวนนับเป็นภาษาละติน
แล้วลงท้ายด้วย -ium จำนวนนับในภาษาละตินมีดังนี้
0 =
(nil) 1 =
(un) 2 =
(bi) 3=(tri) 4 = (quad) 5 = (pent)
6 = (hex)
7 = (sept) 8
= (oct) 9 = (enn)
เช่น ธาตุที่ 113 อ่านว่า Ununtrium
สัญลักษณ์คือ Unt
- การเรียกชื่อธาตุในลักษณะนี้ยังไม่ใช่ชื่อจริงของธาตุ แต่เป็นการเรียกเอาไว้ล่วงหน้าตามตำแหน่งในตารางธาตุ เมื่อมีการคันพบธาตุดังกล่าว จะเปลี่ยนไปใช้ชื่ออื่น เช่น
ธาตุที่ 114 และ
116 ขณะที่ยังไม่พบจะใช้ชื่อว่า Ununquadium (Uud)
และ
Ununhexium (Uuh)
ตามลำดับ
แต่ปัจจุบันมีการสังเคราะห์ธาตุทั้ง
2 ชนิดดังกล่าวได้แล้ว ใช้ชื่อใหม่ว่า Flerovium (114Fl
) Livermorium (115 Lv
) ตามลำดับ
เวเลนซ์อิเล็กตรอนใน
subshell
หรือ subenergy level กับตำแหน่งของธาตุในตารางธาตุ
เมื่อพิจารณาการจัดอิเล็กตรอนของธาตุโดยดูว่าเวเลนซ์อิเล็กตรอนอยู่ใน subshell s
p d หรือ f เราสามารถแบ่งธาตุในตารางออกเป็น
4 กลุ่ม คือ
1. กลุ่ม s
( s-block) คือกลุ่มที่มีเวเลนซ์อิเล็กตรอนอยู่ที่ subshell s
ได้แก่ ธาตุหมู่
1A 2A
2. กลุ่ม p (P-block) คือกลุ่มที่มีเวเลนซ์อิเล็กตรอนอยู่ที่ subshell p
ได้แก่ ธาตุหมู่ 3A
ถึง 8A
3. กลุ่ม d (d-block) คือกลุ่มที่มีเวเลนซ์อิเล็กตรอนอยู่ที่ subshell d
ได้แก่
ธาตุแทรนซิชัน หรือธาตุหมุ่ B
(ส่วนที่อยู่ในตารางหลัก)
4. กลุ่ม f (f-block) คือกลุ่มที่มีเวเลนซ์อิเล็กตรอนอยู่ที่ subshell f ได้แก่ธาตุแทรนซิชันชั้นใน (inner
transition) มี 2
คาบคือ
- คาบบนหรือแถวบน
(แลนทาไนด์) ได้แก่ธาตุที่มีเลขเชิงอะตอม
57-71 เป็นส่วน หนึ่งของธาตุ คาบที่
6
- คาบล่างหรือแถวล่าง(แอคทิไนด์) ได้แก่ธาตุที่มีเลขเชิงอะตอม 89-103
เป็นส่วนหนึ่งของธาตุคาบที่ 7
ธาตุกลุ่มนี้ เป็นธาตุหายาก (rare earth)

(คลิ้กชมธาตุทั้ง
4 กลุ่มในตารางธาตุ)
(คลิ้กชมการจัดอิเล็กตรอนกับตำแหน่งของธาตุในตารางธาตุ)
(คลิ้ก ทดสอบความสามารถในการจำชื่อธาตุและหาตำแหน่งของธาตุในตารางธาตุ)
การจัดอิเล็กตรอนของธาตุตั้งแต่เลขเชิงอะตอม
1 ถึง 104 เป็นดังนี้
|
1 H 1
2
He 2
3 Li 2 1
4 Be 2 2
5 B 2 3
6 C 2 4
7 N 2 5
8 O 2 6
9 F 2 7
10 Ne 2 8
11
Na 2 8
1
12 Mg 2 8
2
13
Al 2 8
3
14 Si 2 8
4
15 P 2 8 5
16 S 2 8 6
17 Cl 2 8 7
18 Ar 2 8 8
19 K 2 8 8 1
20 Ca 2 8
8 2
21
Sc 2 8
9 2
22
Ti 2 8
10 2
23 V 2 8
11 2
24 Cr 2 8
13 1
25 Mn 2 8
13 2
26 Fe 2 8
14 2
27 Co 2
8 15 2
28
Ni
2 8
16 2
29
Cu
2
8 18 1
30 Zn 2 8
18 2
31 Ga 2 8 18 3
32 Ge 2 8
18 4
33 As 2 8
18 5
34 Se 2 8
18 6
35 Br 2 8
18 7
|
36 Kr 2 8
18 8
37 Rb 2 8
18 8 1
38 Sr 2 8
18 8 2
39 Y 2 8
18 9 2
40 Zr 2 8
18 10 2
41 Nb 2 8
18 12 1
42 Mo 2 8
18 13 1
43 Tc 2 8
18 13 2
44 Ru 2 8
18 15 1
45 Rh 2 8
18 16 1
46 Pd 2 8
18 18
47 Ag 2 8
18 18 1
48 Cd 2 8
18 18 2
49 In 2 8
18 18 3
50 Sn tin : 2 8 18
18 4
51 Sb 2
8 18 18 5
52 Te 2
8 18 18 6
53 I 2
8 18 18 7
54 Xe 2
8 18 18 8
55 Cs 2
8 18 18
8 1
56
Ba
2
8 18 18
8 2
57 La 2
8 18 18
9 2
58 Ce 2
8 18 19
9 2
59 Pr 2
8 18 21
8 2
60 Nd 2
8 18 22
8 2
61 Pm 2
8 18 23
8 2
62 Sm 2 8
18 24 8 2
63 Eu 2 8
18 25 8 2
64 Gd 2 8
18 25 9 2
65 Tb 2 8
18 27 8 2
66 Dy 2 8
18 28 8 2
67 Ho 2 8
18 29 8 2
68 Er 2 8
18 30 8 2
69 Tm 2 8
18 32 8 2
70 Yb 2 8
18 32 8 2
|
71 Lu 2 8 18
32 9 2
72 Hf 2 8 18 32
10 2
73 Ta 2
8 18 32
11 2
74 W 2
8 18 32
12 2
75
Re
2
8 18 32
13 2
76 Os 2
8 18 32
14 2
77 Ir 2 8 18
32 15 2
78 Pt 2 8 18
32 17 1
79 Au 2 8
18 32 18 1
80 Hg 2 8
18 32 18 2
81 Tl 2 8
18 32 18 3
82 Pb 2 8
18 32 18 4
83 Bi 2 8
18 32 18 5
84 Po 2 8
18 32 18 6
85 At 2
8 18 32
18 7
86 Rn 2
8 18 32
18 8
87 Fr 2
8 18 32
18 8 1
88 Ra 2
8 18 32
18 8 2
89 Ac 2
8 18 32
18 9 2
90 Th 2 8
18 32 18 10 2
91 Pa 2
8 18 32
20 9 2
92 U 2
8 18 32
21 9 2
93 Np 2 8
18 32 22
9 2
94 Pu 2 8
18 32 24
8 2
95 Am 2 8
18 32 25
8 2
96 Cm 2 8
18 32 25
9 2
97 Bk 2 8
18 32 27
8 2
98 Cf 2 8
18 32 28
8 2
99 Es 2 8
18 32 29
8 2
100 Fm 2 8
18 32 30
8 2
101 Md 2 8
18 32 31
8 2
102 No 2 8
18 32 32
8 2
103 Lr 2 8
18 32 32
9 2
104 Rf 2 8
18 32 32
10 2
|
การมีเวเลนซ์อิเล็กตรอนเท่ากันทำให้ธาตุมีสมบัติทางเคมีคล้ายกัน
เพราะการเกิดปฏิกิริยาเคมีของธาตุจะเกิดขึ้นที่เวเลนซ์อิเล็กตรอน แต่สมบัตินี้จะใช้ได้ดีกับธาตุหมู่ A มากกว่าธาตุหมู่ B
นอกจากความสัมพันธ์ในแนวดิ่ง
(หมู่) และแนวนอน (คาบ) ดังได้กล่าวแล้ว ยังมีความสัมพันธ์ในแนวทแยงมุมอีกด้วย ความสัมพันธ์ระหว่างสมบัติของธาตุกับตำแหน่งของธาตุในตารางธาตุ ที่จะกล่าวถึงต่อไปนี้ได้แก่ขนาดอะตอม (atomic
radius) รวมทั้งขนาดของไอออน ค่าสัมพรรคภาพอิเล็กตรอน (electron affinity) พลังงานไอออไนเซชัน
(Ionization energy) และความเป็นโลหะ
(metallic character) รูปแบบของความสัมพันธ์ระหว่างสมบัติดังกล่าวกับตำแหน่งของธาตุในตารางธาตุเป็นดังแผนภาพ
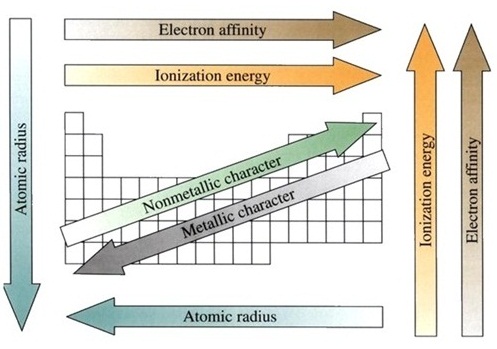
ขนาดอะตอมหรือรัศมีของอะตอม
(atomic radii
หรือ atomic radius )
ถ้าพิจารณาขนาดของอะตอมจากแบบจำลองอะตอมชนิดกลุ่มหมอกอิเล็กตรอน จะบอกขนาดที่แท้จริงของอะตอมไม่ได้ เพราะขนาดของกลุ่มหมอกอิเล็กตรอนมีขอบเขตที่ไม่แน่นอน
ระยะห่างระหว่างนิวเคลียสถึงผิวนอกของอะตอมจึงมีค่าไม่คงที่
ทำให้หาขนาดของอะตอมที่แท้จริงไม่ได้ ถ้าพิจารณาขนาดของอะตอมจากแบบจำลองอะตอมของโบร์
ก็จะไม่ทราบขนาดของอะตอมที่แท้จริงเช่นกัน เพราะ เมื่ออิเล็กตรอนมีพลังงานสูงอิเล็กตรอนจะออกห่างจากนิวเคลียสมาก อะตอมจะมีขนาดใหญ่ขึ้น เมื่ออิเล็กตรอนมีพลังงานต่ำก็จะเข้ามาอยู่ใกล้นิวเคลียสมากขึ้น ขนาดของอะตอมจะเล็กลง
ฉะนั้นขนาดอะตอมจึงไม่แน่นอนขึ้นอยู่กับพลังงานอิเล็กตรอน
เพื่อให้ได้ค่าที่แน่นอนยิ่งขึ้นในการบอกขนาดของอะตอม
จึงบอกด้วยระยะทางครึ่งหนึ่งของระยะห่างระหว่างนิวเคลียสของอะตอม 2
อะตอมที่อยู่ติดกัน ซึ่งก็คือรัศมีของอะตอม นิยมใช้หน่วยเป็นพิโคเมตร (pm) ,
(1 pm = 10-12 m) การที่อะตอม
2 อะตอมจะเข้ามาอยู่ติดกันมีได้หลายวิธีลักษณะ ได้แก่
ถ้าเป็นอะตอมของโลหะกับโลหะจะอยู่ร่วมกันด้วยพันธะโลหะ
รัศมีอะตอมที่ได้จากกรณีนี้จะเรียกว่ารัศมีโลหะ ถ้าเป็นอะตอมของอโลหะกับอโลหะที่อยู่ร่วมกันด้วยพันธะโคเวเลนต์
รัศมีของอะตอมที่ได้จากวิธีนี้จะเรียกว่ารัศมีโคเวเลนต์ ถ้าเป็นอะตอมของอโลหะกับอโลหะที่อยู่ติดกันด้วยแรงวันเดอร์วาลส์
(แรงดึงดูดซึ่งกันและกันแบบอ่อน ๆ )
รัศมีอะตอมที่ได้จากวิธีนี้เรียกว่ารัศมีแวนเดอร์วาลส์ และถ้าเป็นกรณีของโลหะกับอโลหะที่อยู่ร่วมกันด้วยพันธะไอออนิก รัศมีอะตอมที่ได้จากวิธีนี้เรียกว่ารัศมีไอออนิก ฉะนั้นรัศมีของอะตอมจึงมี 4
แบบ ดังนี้
1.1 . รัศมีโลหะ (metallic
radii หรือ metallic radius )
คือการบอกขนาดอะตอมของโลหะจากระยะทางครึ่งหนึ่งของระยะห่างระหว่างอะตอมของโลหะชนิดเดียวกัน
2 อะตอมที่อยู่ติดกัน
ระยะห่างนี้อาจเรียกว่ารัศมีโลหะ
ดังรูป

1.2 . รัศมีโคเวเลนต์ (covalent
radii หรือ covatent radius )
คือการบอกขนาดอะตอมของอโลหะจากระยะทางครึ่งหนึ่งของระยะห่างระหว่างนิวเคลียส ของอะตอมของอโลหะ 2
อะตอมที่สร้างพันธะโคเวเลนต์กัน ดังรูป
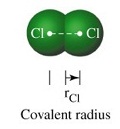
จากรูป ถ้าเป็นโมเลกุลของแก๊สคลอรีน (Cl2)
ความยาวพันธะของ Cl - Cl =
198 พิโคเมตร (pm)
รัศมีโคเวเลนต์ของ Cl =
= 99 พิโคเมตร
1.3 . รัศมีวันเดอร์วาลส์ ( van der waal
radii หรือ van der wall radius) คือการบอกขนาดอะตอมของอโลหะ
จากครึ่งหนึ่งของระยะห่างระหว่างนิวเคลียสของอโลหะ 2 อะตอมซึ่งเป็นธาตุเดียวกันที่อยู่ติดกันโดยไม่ได้สร้างพันธะโคเวเลนต์กัน
แต่มีแรงคึงดูดซึ่งกันและกันด้วยแรงวันเดอร์วาลส์ ดังรูป
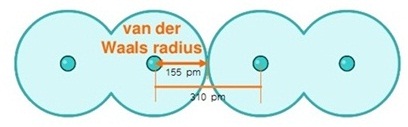
จากรูปถ้าเป็นโมเลกุลของแก๊สคลอรีน
2 โมเลกุล มาอยู่ติดกัน ความยาวของระยะห่างระหว่างนิวเคลียสของคลอรีน 2
อะตอมที่ไม่ได้สร้างพันธะกัน =
310 pm
รัศมีวันเดอร์วาลส์ของ Cl
= =
155 pm
**
รัศมีอะตอมของคลอรีนที่คิดจากรัศมีโคเวเลนต์จะสั้นว่ารัศมีแวนเดอร์วาลส์
1.4 รัศมีไอออนิกหรือรัศมีไอออน (Ionic radius)
เมื่อโลหะทำปฏิกิริยากับอโลหะจะได้พันธะไอออนิก
อะตอมของโลหะจะเสียเวเลนซ์อิเล็กตรอนกลายเป็นไอออนบวก ขนาดของไอออนบวกจะเล็กกว่าขนาดของอะตอมในภาวะปกติ อะตอมของอโลหะจะรับอิเล็กตรอนกลายเป็นไอออนลบ ขนาดของ ไอออนลบจะใหญ่กว่าขนาดของอะตอมในภาวะปกติ
ฉะนั้นรัศมีไอออนิกจะไม่เท่ากับรัศมีของอะตอมในภาวะปกติ
ดังรูป
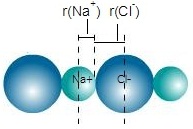
** รัศมีโคเวเลนต์ของคลอรีน = 99 pm
รัศมีวันเดอร์วาลส์ของคลอรีน = 155
pm
รัศมีไอออนิกของคลอรีน = 564 pm (ใน NaCl) , = 555 pm
(ใน AgCl)
ขนาดอะตอมของธาตุเดียวกันเมื่อวัดด้วยวิธีต่างกันจะมีขนาดไม่เท่ากัน รัศมีโคเวเลนต์จะสั้นกว่ารัศมีแวนเดอร์วาลส์
|
ธาตุ
|
ขนาดอะตอม
|
|
รัศมีโคเวเลนต์ (pm)
|
รัศมีวันเดอร์วาลส์ (pm)
|
|
H
O
Cl
P
S
|
37
73
99
110
104
|
120
140
155
180
190
|
การบอกขนาดของอะตอมจึงต้องบอกด้วยว่าเป็นขนาดของอะตอมแบบใด และในการเปรียบเทียบขนาดอะตอมของธาตุต่าง ๆ
จะต้องใช้รัศมีอะตอมประเภทเดียวกัน
ถ้าเราถือว่ารัศมีอะตอมของธาตุหนึ่งๆ
เป็นค่าคงที่ไม่ว่าจะอยู่ในโมเลกุลใด ๆ
ก็จะช่วยให้เราสามารถหารัศมีอะตอมของธาตุอื่น ๆ ได้ เช่น
เราทราบว่ารัศมีอะตอมของ H = 37 pm ไม่ว่าจะอยู่ในโมเลกุลใด ๆ ถ้าเรามีโมเลกุลของ HCl แล้วเราสามารถหาความยาวพันธะ H-Cl
หรือระยะห่างระหว่างนิวเคลียสของ H กับ Cl ได้ 136 pm
รัศมีอะตอมของ
Cl จะมีค่า = 136
- 37
= 99 pm ดังรูป

ขนาดอะตอมกับตำแหน่งของธาตุในตารางธาตุ
การพิจารณาขนาดของอะตอมหรือรัศมีของอะตอม (atomic radius) มี
2 กรณีคือพิจารณาตามคาบและตามหมู่ของธาตุในตารางธาตุ ดังนี้
1. ธาตุคาบเดียวกันขนาดอะตอมจะลดลงจากซ้ายไปขวา
หรือกล่าวว่าธาตุซ้ายมีขนาดอะตอมใหญ่หว่าธาตุขวา เนื่องจากธาตุในคาบเดียวกันย่อมมีจำนวนระดับพลังงานของ อิเล็กตรอนเท่ากัน แต่ธาตุขวามีจำนวนโปรตอนมากกว่า
จึงดึงดูดอิเล็กตรอนให้เข้าไปอยู่ใกล้นิวเคลียสได้มากขึ้น ขนาดอะตอมของธาตุขวาจึงเล็กกว่าธาตุซ้าย แนวโน้มดังกล่าวมีผลชัดเจน สำหรับธาตุหมู่ A แต่สำหรับธาตุหมู่ B แนวโน้มจะไม่แน่นอน
2. ธาตุหมู่เดียวกันธาตุที่อยู่คาบล่างมีขนาดอะตอมใหญ่กว่าธาตุบน
เนื่องจากธาตุคาบล่างมีจำนวนระดับพลังงานของอิเล็กตรอนมากกว่าธาตุบน จึงทำให้มีขนาดอะตอมใหญ่กว่า ด้วย
ขนาดอะตอมของธาตุหมู่เดียวกันจึงเพิ่มขึ้นจากคาบบนสู่คาบล่าง
แต่อย่างไรก็ตามเมื่อพิจารณาที่จำนวนโปรตอนจะพบว่า ธาตุคาบล่างมีจำนวนโปรตอนมากกว่าธาตุคาบบน แต่การเพิ่มขึ้นของจำนวนระดับพลังงานของอิเล็กตรอน มีผลต่อขนาด
ของอะตอมมากกว่าการเพิ่มขึ้นของจำนวนโปรตอน แนวโน้มของรัศมีอะตอมตามคาบและหมู่เป็นดังรูป

(คลิ้ก ชมแนวโน้มของขนาดอะตอมกับตำแหน่งของธาตุในตารางธาตุ)
(คลิ้กเปิดตารางธาตุ ดูแนวโน้มของขนาดอะตอม)
ขนาดของไอออนหรือรัศมีของไอออน
เมื่อเปรียบเทียบกับขนาดอะตอมในภาวะปกติ
เมื่อมีการถ่ายเทอิเล็กตรอนระหว่างอะตอม
มีผลให้อะตอมเปลี่ยนเป็นไอออน อะตอมที่เสียอิเล็กตรอนจะเป็นไอออนบวก
ในขณะที่อะตอมที่ได้รับอิเล็กตรอนจะเป็นไอออนลบ ขนาดของไอออนจะเปลี่ยนไปเมื่อเปรียบเทียบกับขนาดของอะตอมในภาวะปกติ
* ไอออนบวก (cation) จะมีขนาดเล็กกว่าขนาดของอะตอมในภาวะปกติ เพราะเมื่อมีจำนวนอิเล็กตรอนลดลง
อิเล็กตรอนจะได้รับแรงดึงดูดจากนิวเคลียสมากขึ้น ทำให้เคลื่อนที่เข้าไปใกล้นิวเคลียสมากกว่าเดิม
* ไอออนลบ (anion) จะมีขนาดใหญ่กว่าขนาดของอะตอมในภาวะปกติ เพราะเมื่อมีจำนวนอิเล็กตรอนมากขึ้น อิเล็กตรอนจะได้รับแรงดึงดูดจากนิวเคลียสน้อยลง ทำให้เคลื่อนที่ออกห่างจากนิวเคลียสมากกว่าเดิม
ถ้าเปรียบเทียบกันระหว่างขนาดของอะตอมปกติกับขนาดของไอออนบวก ไอออนบวกจะมีขนาดเล็กกว่าอะตอมปกติ
ในขณะที่ไอออนลบจะมีขนาดใหญ่กว่าอะตอมปกติ แนวโน้มในการเพิ่มขึ้นหรือลดลงของขนาดของไอออน ตามหมู่และคาบ
เป็นดังรูป ( สีอ่อนคือขนาดอะตอมในภาวะปกติ สีเข้มคือขนาดของไอออน)
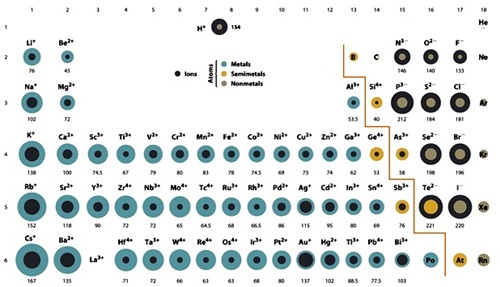
แนวโน้มในการเพิ่มขึ้นหรือลดลงของขนาดของไอออนตามหมู่และคาบ
มีลักษณะเช่นเดียวกับการเพิ่มขึ้นหรือลดลงของขนาดอะตอม แต่อย่าลืมว่าไอออนบวกมีขนาดเล็กกว่าอะตอมปกติ ไอออนลบมีขนาดใหญ่กว่าอะตอมปกติ
แต่แนวโน้มในการเพิ่มขึ้นหรือลดลดตามตำแหน่งในตารางธาตุเป็นแบบเดียวกัน
สิ่งที่จะต้องพิจารณาอีกกรณีหนึ่งก็คือ ไอออนต่างชนิดที่มีจำนวนอิเล็กตรอนเท่ากัน ขนาดของไอออนจะเปรียบเทียบกันได้อย่างไร พิจารณาข้อมูลจากตาราง

จากตาราง
จะเห็นได้ว่าเป็นไอออนของธาตุต่างชนิด
แต่ทุกไอออนมีอิเล็กตรอน 10
ตัวเท่ากัน แต่ขนาดของไอออนไม่เท่ากัน
ให้ดูที่จำนวนโปรตอนถ้ามีน้อยกว่าขนาดไอออนจะใหญ่กว่า เรียงลำดับได้ดังนี้
C4- >
N3- > O2-
> F- >
Na+ > Mg2+
> Al3+
สำหรับอะตอมของธาตุเดียวกันที่เป็นไอออนได้มากกว่า 1
ชนิด เช่น Fe2+ กับ Fe3+ , Sn2+ กับ Sn4+ S-
กับ S2- หลักการพิจารณาก็คือ ถ้าเป็นไอออนบวก ยิ่งมีประจุบวกมากขึ้นขนาดจะยิ่งเล็กลง ในถ้าเป็นไอออนลบ ถ้ามีประจุลบมากขึ้นขนาดจะยิ่งใหญ่ขึ้น
(คลิ้ก
ชมแนวโน้มของขนาดอะตอมกับตำแหน่งในตารางธาตุ มีคำอธิบาย)
(คลิ้กชมตารางธาตุแสดงแนวโน้มของขนาดไอออน)
พลังงานไอออไนเซชัน (ionization energy ,
IE)
หมายถึง
พลังงานที่ทำให้อะตอม (หรือไอออนบวก) ที่มีสถานะเป็นแก๊สเกิดการเสียอิเล็กตรอน กลายเป็นไอออนบวก
หรือเป็นไอออนบวกที่มีประจุบวกเพิ่มขึ้น และยังคงมีสถานะเป็นแก๊สเช่นเดิม เช่น
H(g)
+1,318 kJ/mol è
H+(g) + e-
; IE1
= 1,318 kJ/mol
พลังงาน 1,318 kJ/mol
คือพลังงานไอออไนเซชันลำดับที่ 1 ของ H แต่เนื่องจากอะตอมของ H มีอิเล็กตรอนเพียง 1
ตัว
ฉะนั้นพลังงานไอออไนเซชันจึงมีเพียง
1 ค่า
จำนวนค่าของพลังงานไอออไนเซชันของแต่ละธาตุ จะมีเท่ากับจำนวนอิเล็กตรอนที่ธาตุนั้น ๆ
มีอยู่ เช่น 1H
2He 3Li 4Be 5B 6C
7N 8O ธาตุเหล่านี้จะมีจำนวนค่าของพลังงานไอออไนเซชัน
(IE) เท่ากับ 1
2 3 4
5 6 7 และ 8 ค่า
ตามลำดับ
ธาตุไฮโดรเจนมีพลังงานไอออไนเซชันเท่ากับ
1,318 กิโลจูลต่อโมล
หมายความว่าเราต้องให้พลังงาน 1,318 กิโลจูล กับอะตอมของไฮโดรเจนจำนวน 1 โมล ( 6.02 x 1023 อะตอม) ขณะที่มีสถานะเป็นแก๊ส จึงจะทำให้อะตอมของไฮโดรเจนดังกล่าวเสียอิเล็กตรอน กลายเป็นไอออนของไฮโดรเจน (H+) ซึ่งยังมีสถานะเป็นแก๊สอย่างเดิม
ธาตุที่มีอิเล็กตรอนมากกว่า 1 ตัว เช่น ธาตุลิเทียม (3Li) มีอิเล็กตรอน 3
ตัว จะมีค่า IE จำนวน 3 ค่า ดังนี้
Li(g) + 520 kJ/mol → Li+(g) + e-
IE1
= 520 kJ/mol
Li+(g) + 7,394 kJ/mol → Li2+(g) + e-
IE2
= 7,394 kJ/mol
Li2+(g) + 11,815 kJ/mol → Li3+(g) + e-
IE3 =
11,815 kJ/mol
เมื่อนำมาเขียนเรียงลำดับค่า IE ทั้ง 3
ค่าจะเป็นดังนี้
|
ธาตุ
|
IE1 kJ/mol
|
IE2 kJ/mol
|
IE3 kJ/mol
|
|
Li
|
520
|
7,394
|
11,815
|
สิ่งที่จะต้องทำความเข้าใจให้ถูกต้องก็คือ IE1 หมายถึงพลังงานที่เราให้แก่อะตอมที่อยู่ในสถานะแก๊ส (g)
เพื่อทำให้อิเล็กตรอนตัวที่ 1 (เวเลนซ์อิเล็กตรอน) หลุดออกจากอะตอมไป อิเล็กตรอนตัวที่
1 เป็นอิเล็กตรอนที่มีพลังงานสูงที่สุดของอะตอมนั้น ๆ จึงใช้พลังงานน้อยเมื่อเปรียบเทียบกับค่า IE ค่าต่อ ๆ ของธาตุนั้น ค่า IE1
ของทุก ๆ ธาตุจึงมีค่าน้อยที่สุดในบรรดาค่า IE
ทั้งหมดของธาตุนั้น ๆ แต่ IE1
ของธาตุต่างชนิดไม่จำเป็นต้องมีค่าเท่ากัน
อิเล็กตรอนตัวที่เหลือจะมีพลังงานอยู่ในตัวน้อยลงตามลำดับ จึงต้องใช้พลังงานเพิ่มขึ้นตามลำดับเช่นกัน ค่า IE2 IE3 IE4 …. จะมีค่าเพิ่มขึ้น
จนกระทั่งถึงอิเล็กตรอนตัวสุดท้ายของแต่ละธาตุ จะเป็นอิเล็กตรอนที่มีพลังงานต่ำที่สุดของธาตุนั้น
ๆ ฉะนั้นค่า IE สุดท้ายของแต่ละธาตุจึงมีค่าสูงสุด
Ionization Energies of certain elements
(1st IE, 2nd IE, etc)
|
Element
|
1st
|
2nd
|
3rd
|
4th
|
5th
|
6th
|
7th
|
|
|
Na
|
496
|
4562
|
|
|
|
|
|
|
|
Mg
|
738
|
1451
|
7733
|
|
|
|
|
|
|
Al
|
577
|
1817
|
2745
|
11580
|
|
|
|
|
|
Si
|
786
|
1577
|
3232
|
4356
|
16090
|
|
|
|
|
P
|
1060
|
1903
|
2912
|
4957
|
6274
|
21270
|
|
|
|
S
|
999.6
|
2251
|
3361
|
4564
|
7013
|
8496
|
27110
|
|
|
Cl
|
1256
|
2297
|
3822
|
5158
|
6542
|
9362
|
11020
|
|
|
Ar
|
1520
|
2666
|
3931
|
5771
|
7238
|
8781
|
12000
|
|
ความสัมพันธ์ระหว่างพลังงานไอออไนเซชันลำดับที่
1 (IE1) กับตำแหน่งของธาตุในตารางธาตุพบว่า ธาตุหมู่เดียวกันธาตุคาบบนจะมีค่า IE1 สูงกว่าธาตุคาบล่าง ธาตุคาบเดียวกันธาตุขวาจะมีค่า IE1 สูงกว่าธาตุซ้าย ดังรูป

(คลิ้กชมแนวโน้มของค่า IE1 ตามหมู่และตามคาบ)
การที่ ธาตุคาบบนของธาตุในหมู่เดียวกัน
มีพลังงาน IE1 มากกว่าธาตุคาบล่าง เป็นเพราะธาตุคาบบนมีขนาดอะตอมเล็กกว่าธาตุล่าง
ทำให้อิเล็กตรอนกับนิวเคลียสอยู่ใกล้กันมากกว่า แรงดึงดูดระหว่างนิวเคลียสกับอิเล็กตรอนจึงมีมาก
จึงต้องใช้พลังงานมากในการทำให้อิเล็กตรอนหลุดออกจากอะตอมไป กล่าวโดยรวม ๆ ได้ว่าค่า IE แปรผกผันกับขนาดของอะตอม อะตอมที่มีขนาดใหญ่จะมีค่า IE น้อยกว่าอะตอมที่มีขนาดเล็ก
สำหรับธาตุในคาบเดียวกัน ค่า
IE จะเพิ่มขึ้นจากซ้ายไปขวา
เนื่องจากธาตุขวามีขนาดอะตอมเล็กกว่าธาตุซ้าย
ระยะห่างระหว่างอิเล็กตรอนกับนิวเคลียสจึงลดลง นอกจากนั้นแล้วธาตุขวายังมีจำนวนโปรตอนมากกว่าธาตุซ้ายด้วย
จึงมีแรงดึงดูดระหว่างนิ
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|