สมดุลเคมี (ตอนที่ 2) การเปลี่ยนแปลงภาวะสมดุล
การเปลี่ยนแปลงภาวะสมดุล
หลังจากที่ระบบเข้าสู่ภาวะสมดุลแล้วก็ไม่ได้หมายความว่าจะยืนยาวคงสภาพนั้นไปได้ตลอด เมื่อเข้าสู่ภาวะสมดุลแล้วก็อาจถูกรบกวนทำให้เสียภาวะสมดุลไปได้อีก หลังจากนั้นจะกลับเข้าสู่ภาวะสมดุลได้อีกหรือไม่ ก็ขึ้นอยู่กับปัจจัยที่มารบกวนภาวะสมดุลนั้น ๆ ว่ามีความรุนแรงเพียงใด ถ้าปัจจัยที่มารบกวนไม่รุนแรงมากจนเกินไป สมดุลส่วนใหญ่จะปรับตัวเข้าสู่ภาวะสมดุลได้ใหม่แต่จะไม่ใช่สมดุลเดิม
ปัจจัยที่จะมีผลให้ภาวะสมดุลต้องเสียไปนั้น ก็คือปัจจัยที่มีผลต่ออัตราเร็วของปฏิกิริยา ดังเป็นที่ทราบแล้วว่าระบบใด ๆ ก็ตามเมื่ออยู่ในภาวะสมดุลนั้นอัตราเร็วของการเปลี่ยนแปลงไปข้างหน้า กับอัตราเร็วของการเปลี่ยนแปลงย้อนกลับจะมีค่าเท่ากัน ฉะนั้นเมื่อภาวะสมดุลได้รับปัจจัยใด ๆ ที่มีผลให้อัตราเร็วของปฏิกิริยาไปข้างหน้าหรืออัตราเร็วของปฏิกิริยาย้อนกลับเปลี่ยนแปลงไปจากเดิมแล้ว ภาวะสมดุลก็จะเสียไปทันที
ในเรื่องที่เกี่ยวกับผลของปัจจัยที่มีจ่ออัตราเร็วของปฏิกิริยานี้ นักเคมีชาวฝรั่งเศสชื่อ อองรี ลุย เลอ ชาเตอลิเอ (Henri Louis Je Chatelier) (คลิ้ก อ่านประวัต Chatelier) ซึ่งมีชีวิตอยู่ระหว่าง พ.ศ. 2393-2479 ได้ศึกษาค้นคว้าและสรุปผลว่าเมื่อใช้ปัจจัยใด ๆ มารบกวนภาวะสมดุลแล้ว ภาวะสมดุลจะปรับตัวไปในทิศทางที่จะลดความรุนแรงของปัจจัยที่มารบกวนนั้นเพื่อเข้าสู่ภาวะสมดุลใหม่ เช่น A ↔ B อยู่ในภาวะสมดุล
- ถ้าเติม A ลงไป การเปลี่ยนแปลงจาก A → B จะเกิดได้ดีขึ้น
- ถ้าเติม B ลงไป การเปลี่ยนแปลงจาก B → A จะเกิดได้ดีขึ้น
ปัจจัยที่มีผลต่อการเปลี่ยนแปลงภาวะสมดุลมีดังนี้
1. ความเข้มข้นของสารในภาวะสมดุล
ระบบต่าง ๆ ที่อยู่ในภาวะสมดุลนั้น สารเคมีที่อยู่ทางซ้ายของสมการเคมีทำหน้าที่เป็นสารตั้งต้นของปฏิกิริยาไปข้างหน้า ในเวลาเดียวกันสารที่อยู่ทางขวาของสมการเคมีจะทำหน้าที่เป็นสารตั้งต้นของปฏิกิริยาย้อนกลีบ ฉะนั้นไม่ว่าจะเปลี่ยนแปลงปริมาณของสารชนิดใดชนิดหนึ่ง ก็ย่อมจะมีผลให้อัตราเร็วของปฏิกิริยาในทิศทางใดทิศทางหนึ่งเปลี่ยนแปลงไป ทำให้ภาวะสมดุลเปลี่ยนแปลงไปด้วย
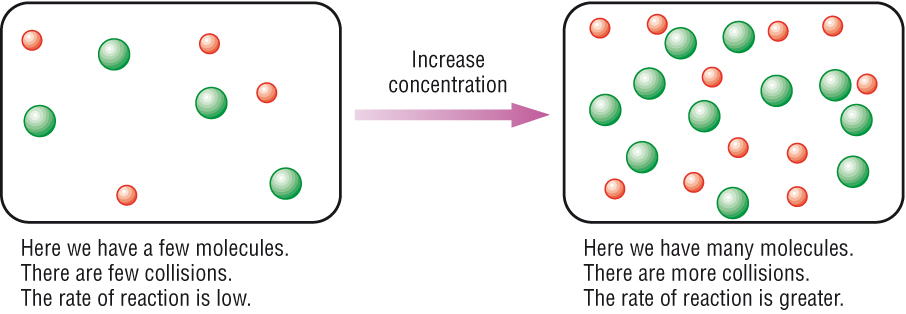
ถ้าภาวะสมดุลเป็นดังนี้
H2(g) + I2(g) ↔ 2HI(g)
เมื่อเราเติมสาร H2 ซึ่งเป็นสารตั้งต้นของปฏิกิริยาไปข้างหน้าลงไป อัตราเร็วของปฏิกิริยาไปข้างหน้าก็จะเพิ่มขึ้นทันที อาจเรียกว่าภาวะสมดุลเลื่อนไปทางขวา ผลก็คือมีสาร HI เพิ่มขึ้น ขณะที่ I2 ลดลง เนื่องจากต้องใช้ไปอีกเพื่อการเกิดปฏิกิริยาไปข้างหน้าที่เพิ่มขึ้น ทำให้ H2 ที่เติมลงไปนั้นก็จะถูกกำจัดให้เหลือน้อยลง แต่ก็ยังเหบืออยู่มากกว่าก่อนเติม แล้วเข้าสู่ภาวะสมดุลใหม่อีกครั้งหนึ่ง (final equilibrium ) แต่ไม่ใช้สมดุลเดิม (initial equilibrium ) ดังกราฟ
** ถ้าอุณหภูมิคงที่ ค่า K ของสมดุลเดิมกับ K ของสมดุลใหม่เป็นค่าเดียวกัน แต่ภาวะสมดุลเดิมกับภาวะสมดุลใหม่ไม่ใช่สมดุลเดียวกัน
- ในทำนองเดียวกันให้ลองพิจารณาดูว่าถ้าเติมเฉพาะสาร B จะได้ผลอย่างไร
- ถ้าเติมสาร AB จะได้ผลอย่างไร
- ถ้าแยกสาร A ออกจากระบบจะได้ผลอย่างไร
- ถ้าแยกสาร B ออกจากระบบจะได้ผลอย่างไร
- ถ้าแยกสาร AB ออกจากสมดุลจะได้ผลอย่างไร
2. ผลของความดันที่มีต่อภาวะสมดุลของก๊าซ
ในกรณีที่เป็นภาวะสมดุลของก๊าซนั้น ถ้าเราพิจารณาสมบัติของก๊าซตามทฤษฎีจลน์ของก๊าซ เราก็จะทราบว่าโมเลกุลของก๊าซอยู่ห่างกันมีที่ว่างมาก ถ้าก๊าซมีจำนวนโมลคงที่ (มวลคงที่ จำนวนโมเลกุลคงที่) การเพิ่มหรือลดลงของปริมาตรของก๊าซก็จะมีผลให้ระยะห่างระหว่างโมเลกุลของก๊าซเปลี่ยนไป การที่ปริมาตรของก๊าซเปลี่ยนไปในขณะที่มวลของก๊าซ หรือจำนวนโมเลกุลของก๊าซคงที่ จึงมีผลให้ความหนาแน่นของก๊าซเปลี่ยนไปด้วย จะเรียกว่าความเข้มข้นเปลี่ยนไปก็ได้
การเพิ่มความดันโดยลดปริมาตรของก๊าซ จึงมีผลให้ความหนาแน่นของก๊าซเพิ่มขึ้น ซึ่งก็หมายถึงทำให้ความเข้มข้นในหน่วยโมล/ลิตรเพิ่มขึ้นนั่นเอง จึงมีผลให้อัตราเร็วของปฏิกิริยาในภาวะสมดุลเปลี่ยนไป ทำให้ภาวะสมดุลเปลี่ยนไป
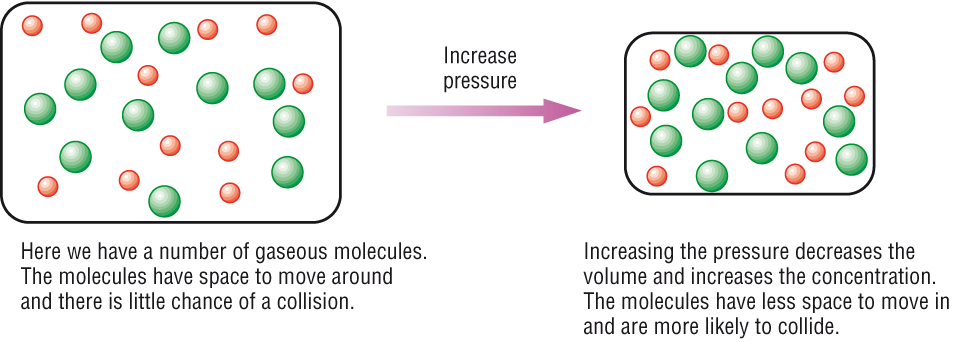
ถ้าภาวะสมดุลของก๊าซคือ
3H2(g) + N2(g) ↔ 2NH3(g) ; ปริมาตร 1 ลิตร
ความเข้มข้นของสาร 3M 1M 2M
ถ้าเพิ่มความดันขึ้นเป็น 2 เท่า ปริมาตรก็จะลดลงเหลือครึ่งหนึ่งของปริมาตรเดิม (ตามกฎของบอยล์) ทำให้ความเข้มข้นของก๊าซทุกชนิดเพิ่มขึ้นเป็น 2 เท่า ดังนี้
3H2(g) + N2(g) ↔ 2NH3(g) ; ปริมาตร 1 ลิตร
ความเข้มข้นของสาร 6M 2M 4M
ผลของการเพิ่มความดันโดยการลดปริมาตรลงครึ่งหนึ่งดังกล่าวมานี้ แม้จะทำให้ความเข้มข้นของก๊าซเพิ่มขึ้นเป็น 2 เท่า ทั้งทางซ้ายและทางขวาก็ตาม แต่จำนวนโมลของก๊าซทางซ้ายมากกว่าก๊าซทางขวา จึงมีผลให้ปฏิกิริยาจากซ้ายไปขวาเกิดได้ดีขึ้น หรือเรียกว่าภาวะสมดุลเลื่อนไปทางขวา เพื่อให้สะดวกและง่ายต่อการทำความเข้าใจจึงอาจกล่าวในหลักการโดยสรุปว่า ในภาวะสมดุลต่าง ๆ ของก๊าซ ถ้าจำนวนโมลของก๊าซทางซ้ายและทางขวาเท่ากัน ความดันจะไม่มีผลต่อการเปลี่ยนแปลงภาวะสมดุลนั้น ๆ เช่น H2(g) + Cl2(g) → 2HCl(g) แต่สำหรับภาวะสมดุลของก๊าซที่มีจำนวนโมลของก๊าซทางซ้ายกับทางขวาไม่เท่ากันแล้ว ความดันจะมีผลต่อภาวะสมดุลนั้น เช่น 3H2(g) + N2(g) ↔ 2NH3(g) ผลของความดันต่อภาวะสมดุลมีหลักการทั่วไปดังนี้
- เมื่อเพิ่มความดันจะมีผลให้ปฏิกิริยาจากด้านที่มีจำนวนโมลของก๊าซมากกว่า ไปทางด้านที่มีจำนวนโมลของก๊าซน้อยกว่าจะเพิ่มขึ้น
(กรณีนี้ถ้าเพิ่มความดันจะได้ NH3 มากขึ้น)
- ถ้าลดความดันจะมมีผลให้ปฏิกิริยาจากด้านที่มีจำนวนโมลของก๊าซน้อยกว่า ไปทางด้านที่มีจำนวนโมลของก๊าซมากกว่าจะเพิ่มขึ้น
(กรณีนี้ถ้าลดความดัน NH3 จะเหลือน้อยลง)
3. ผลของอุณหภูมิที่มีต่อภาวะสมดุล
ในภาวะสมดุลต่าง ๆ ย่อมมีทั้งการเปลี่ยนแปลงไปข้างหน้าและย้อยกลับเกิดขึ้นพร้อมกันอยู่ตลอดเวลา การเปลี่ยนแปลงดังกล่าวนี้ถ้าด้านหนึ่งเป็นแบบดูดความร้อนอีกด้านหน่ึงก็จะเป็นแบบคายความร้อน ดังรูป

ฉะนั้นไม่ว่าจะเพิ่มหรือลดอุณหภูมิก็จะมีผลให้ภาวะสมดุลเปลี่ยนแปลงได้ทั้งสองกรณี คือ ถ้าเพิ่มอุณหภูมิการเปลี่ยนแปลงทางด้านดูดความร้อนจะเกิดได้ดีขึ้น แต่ถ้าลดอุณหภูมิการเปลี่ยนแปลงทางด้านคายความร้อนจะเกิดได้ดีขึ้น
- กรณีนี้ถ้าเพิ่มอุณหภูมิจะได้ C มากขึ้น
- ถ้าลดอุณหภูมิ C จะเหลือน้อยลง
(คลิ้ก ศึกษาเพิ่มเติมหลักของชาร์เตอริเอ)
(คลิ้ก ชมการทดลองเสมือนจริง ผลของอุณหภูมิต่อภาวะสมดุลระหว่าง 2NO2 ↔ N2O4)
(คลิ้ก ทำการทดลองเสมือนจริง แสดงผลของปัจจัยต่าง ๆ ที่มีต่อภาวะสมดุล)
การเปลี่ยนแปลงของค่าคงที่สมดุล
ในหัวข้อที่ผ่านมาเป็นการพิจารณาเรื่องการเปลี่ยนแปลงภาวะสมดุล แต่ในหัวข้อนี้จะพิจารณาที่การเปลี่ยนแปลงของค่าคงที่สมดุลบ้าง ขอให้ทราบหลักการในเบื้องต้นว่าค่าคงที่สมดุลเป็นค่าคงที่เมื่ออุณหภูมิคงที่ ถ้าเปลี่ยนอุณหภูมิก็จะทำให้ค่าคงที่สมดุลเปลี่ยนไปด้วย ฉะนั้นปัจจัยเรื่องความเข้มข้นและความดันที่ทำให้เกิดการเปลี่ยนแปลงภาวะสมดุลนั้น ถ้าตราบใดที่อุณหภูมิยังคงที่แล้ว แม้ว่าภาวะสมดุลจะเปลี่ยนไปแต่ค่าคงที่สมดุลยังเป็นค่าเดิม
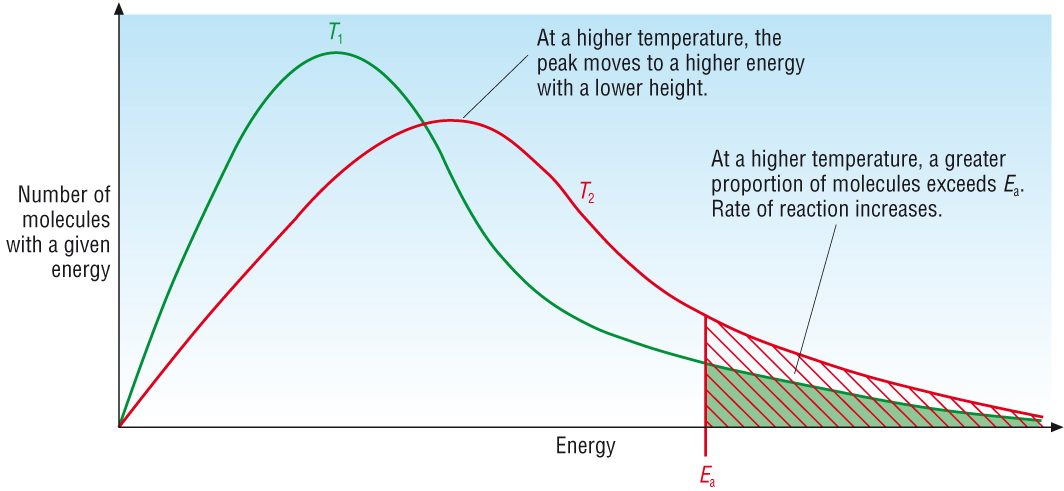
ปัจจัยที่จะทำให้เกิดการเปลี่ยนแปลงทั้งภาวะสมดุลและค่าคงที่สมดุลไปพร้อมกันก็คืออุณหภูมิ ลองย้อนกลับไปที่พลังงานก่ออัมมันต์ (Ea) ในเรื่องอัตราเร็วของปฏิกิริยา ดังกราฟ
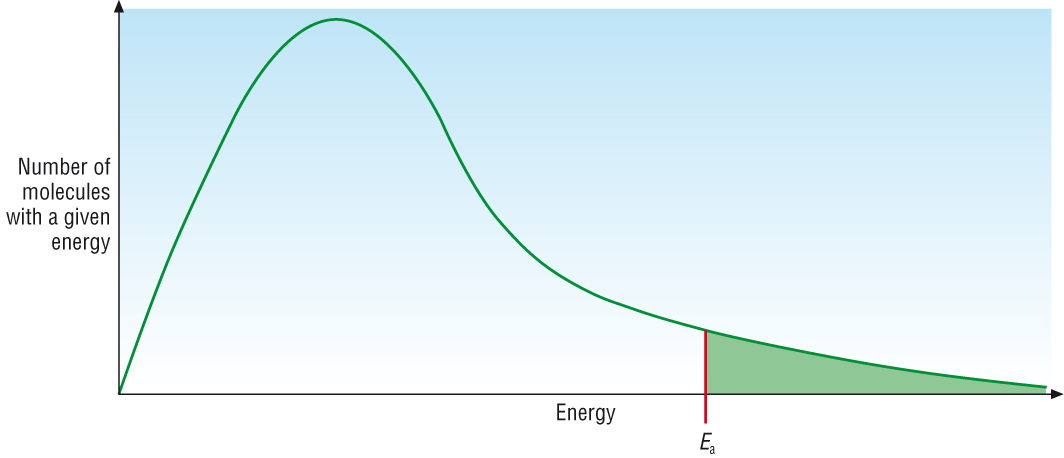
พื้นที่ทั้งหมดใต้เส้นกราฟสีเขียวแทนจำนวนยโมเลกุลทั้งหมดของสารซึ่งมีพลังงานมาก-น้อยต่าง ๆ กัน ค่า Ea คือพลังงานก่อกัมมันต์ของปฏิกิริยา พื้นที่ทางด้านขวาของ Ea ซึ่งระบายด้วยสีเขียว แทนจำนวนโมเลกุลหรือจำนวนโมลของสารที่มีพลังงานสูงถึงค่า Ea ของปฏิกิริยา โมเลกุลส่วนนี้จะเกิดปฏิกิริยาได้แล้วเปลี่ยนไปเป็นผลิตภัณฑ์ ส่วนของพิ้นที่ทางซ้ายของบค่า Ea แทนจำนวนโมเลกุลหรือจำนวนโมลของสารที่มีพลังงานต่ำกว่าค่า Ea โมเลกุลส่วนนี้เกิดปฏิกิริยาไม่ได้ ยังคงอยู่ในสภาพของสารตั้งต้นต่อไป
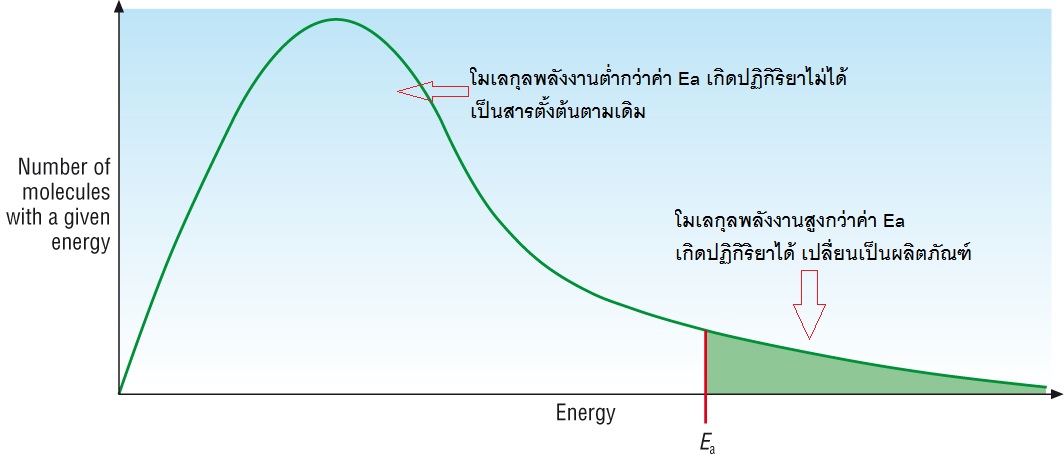
ค่าคงที่สมดุล (K) คิดจากอัตราส่วนระหว่าง ผลิตภัณฑ์ : สารตั้งต้น ภาวะสมดุลใดๆ ก็ตามเมื่ออุณหภูมิคงที่ แม้จะทำการเปลี่ยนแปลงด้วยปัจจัยต่าง ๆ ที่ทำให้ภาวะสมดุลเปลี่ยนไป แต่อัตราส่วนระหว่าง ผลิตภัณฑ์ : สารตัวต้น ก็จะเป็นอัตราส่วนเดิม
แต่ถ้าเพิ่มอุณหภูมิ โมเลกุลของสารทั้งหมดก็จะมีพลังงานสูงขึ้น ทำให้มีโมเลกุลอีกจำนวนหนึ่งมีพลังงานถึงระดับค่า Ea เกิดปฏิกิริยาได้ รวมกับโมเลกุลพลังงานสูงถึงค่า Ea ที่มีอยู่ก่อน ทำให้มีจำนวนโมเลกุลหรือจำนวนโมลของสารที่จะเปลี่ยนไปเป็นผลิตภัณฑ์ได้มากขึ้น ส่วนที่เหลืออยู่เป็นสารตั้งต้นจะน้อยลง ค่า K จึงเปลี่ยนไป
การเปลี่ยนค่าคงที่สมดุลโดยวิธีทางสมการ
สมการเคมีกับสมการทางคณิตศาสตร์มีส่วนคล้ายกันที่สามารถนำมาบวก ลบ ... กันได้ การกระทำดังกล่าวมีผลให้ค่าคงที่สมดุงเปลี่ยนแปลงด้วย ดังนี้
1. กลับสมการสมการภาวะสมดุล จะมีผลให้
ค่าคงที่สมดุลใหม่ = 1 / ค่าคงที่สมดุลเดิม
ตัวอย่าง A(aq) + B(aq) ↔ AB(aq) ; K = a
เมื่อกลับสมการจะเป็นดังนี้
AB(aq) ↔ A(aq) + B(aq) ; K = 1/a
2. คูณสมการภาวะสมดุลด้วยจำนวนใด ๆ (n) จะมีผลให้
ค่าคงที่สมดุลของสมการผลคูณ = (ค่าคงที่สมดุลเดิม)n
หรือ K(ใหม่) = (Kเดิม)n
ตัวอย่าง A(aq) + B(aq) ↔ AB(aq) ; K = x
ถ้าคูณสมการด้วย 2 จะเป็นดังนี้
2A(aq) + 2B(aq) 2AB(aq) ; K = (x)2
3. หารสมการภาวะสมดุลด้วยจำนวนใด ๆ (n) จะมีผลให้
ค่าคงที่สมดุลของสมการผลหาร = n√Kเดิม หรือ (Kเดิม)1/n
ตัวอย่าง 2A(aq) + 2B(aq) ↔ 2AB(aq) ; K = x
เมื่อหารสมการด้วย 2 จะเป็นดังนี้
A(aq) + B(aq) ↔ AB(aq) ; K = √ x หรือ (x)1/2
4. ถ้านำสมการย่อยหลายสมการมารวมกัน ค่าคงที่สมดุลของสมการรวมเท่ากับผลคูณของ K สมการย่อย ดังนี้
สมดุลที่ 1 A(aq) + B(aq) ↔ AB(aq) ; K1 = x
สมดุลที่ 2 B(aq) + C(aq) ↔ BC(aq) ; K2 = y
รวมสมดุล 1+2 จะเป็นดังนี้
A(aq) + B(aq) + B(aq) + C(aq) ↔ AB(aq) + BC(aq)
A(aq) + 2B(aq) + C(aq) ↔ AB(aq) + BC(aq) K(สมการรวม) = xy
5. ถ้านำสมการย่อยหลายสมการมาลบกัน ค่าคงที่สมดุลของสมการผลลบ เท่ากับผลหารของค่าคงที่สมดุลสมการย่อย ดังนี้
สมดุลที่ 1 A(aq) + B(aq) ↔ AB(aq) ; K1 = x
สมดุลที่ 2 B(aq) + C(aq) ↔ BC(aq) ; K2 = y
5.1 สมดุลที่ 1 - สมดุลที่ 2 จะเป็นดังนี้
A(aq) + B(aq) - B(aq) - C(aq) ↔ AB(aq) - BC(aq)
A(aq) + BC(aq) ↔ AB(aq) + BC(aq) ; K(สมการผลลบ) = x/y
5.2 สมดุลที่ 2 - สมดุลที่ 1 จะเป็นดังนี้
B(aq) + C(aq) - A(aq) - B(aq) ↔ BC(aq) - AB(aq)
C(aq) - A(aq) ↔ BC(aq) - AB(aq)
C(aq) + AB(aq) ↔ BC(aq) + A(aq) ; K(สมการผลลบ) = y/x
************************************
รูปภาพที่เกี่ยวข้อง

Size : 247.26 KBs
Upload : 2013-07-21 05:52:30
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|