ปริมาณสารสัมพันธ์ ตอนที่ 9/4 การคำนวณจากสมการมากกว่า 1 สมการที่เกิดขึ้นอย่างอิสระ
ปฏิกิริยามากกว่า 1 ปฏิกิริยาแต่เกิดขึ้นอย่างอิสระ
ลักษณะของปฏิกิริยาประเภทนี้จะมีปฏิกิริยาอย่างน้อย 2 ปฏิกิริยาเกิดขึ้น โดยแต่ละปฏิกิริยาเกิดขึ้นได้อย่างอิสระ ไม่ต้องรอให้ปฏิกิริยาใดเกิดขึ้นก่อนหรือสิ้นสุดไปก่อน
เช่น ก๊าซหุงต้มซึ่งประกอบด้วยโพรเพน (C3H8) กับบิวเทน (C4H10) เมื่อติดไฟก๊าซทั้ง 2 ชนิดก็จะเกิดการเผาไหม้ไปพร้อม ๆ กัน จึงเขียนสมการเคมีได้ 2 สมการ ดังนี้
C3H8 + 5O2 → 3CO2 + 4H2O
C4H10 + 13/2 O2 → 4CO2 + 5H2O
นอกจากนั้นอาจเป็นการนำปฏิกิริยาอย่างน้อย 2 ปฏิกิริยาที่ไม่จำเป็นต้องเกิดขึ้นในที่เดียวกันมาเปรียบเทียบกัน เช่น เปรียบเทียบการเตรียมก๊าซ H2 จากปฏิกิริยา
อย่างน้อย 2 ปฏิกิริยา เช่น
Zn + H2SO4 → ZnSO4 + H2
Mg + 2HCl → MgCl2 + H2
จากสมการจะเห็นได้ว่ามีก๊าซ H2 เกิดขึ้นทั้ง 2 ปฏิกิริยา ซึ่งไม่จำเป็นว่าจะต้องเกิดขึ้นพร้อมกันในสถานที่เดียวกันก็ได้ แต่นำมาเปรียบเทียบกันได้ เช่น
- ถ้าใช้ Zn กับ Mg หนักเท่ากัน ก๊าซ H2 จะได้เท่ากันหรือไม่ อย่างไร
- ถ้าใช้ Zn จำนวน x กรัม จะต้องใช้ Mg กี่กรัม จึงจะได้ H2 เท่ากัน
- อื่น ๆ อีกหลากหลายรูปแบบ
ตัวอย่าง การเตรียมก๊าซ H2 จากปฏิกิริยาดังสมการ
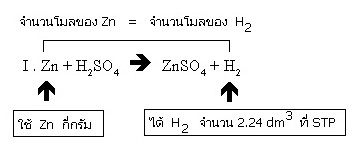
I . Zn + H2SO4 → ZnSO4 + H2
II. Mg + 2HCl → MgCl2 + H2
การทดลองครั้งแรกเตรียมก๊าซ H2 จำนวน 2.24 dm3 ที่ STP จากปฏิกิริยา I. แต่เมื่อจะทดลองอีกครั้งหนึ่งปรากฏว่า Zn หมด จึงเปลี่ยนมาเตรียมก๊าซ H2
ปริมาณเดียวกันจากสมการ II จงหาน้ำหนักของ Zn และ Mg ที่ใช้ (กรัม) (H=1 O=16 Mg=24 Cl=35.5 Zn=65)
วิธีทำ การทำโจทย์ประเภทนี้ควรพิจารณาให้ดีก่อนว่าโจทย์กำหนดสิ่งใดมาให้ และโจทย์ต้องการทราบสิ่งใด กรณีนี้โจทย์ให้ข้อมูลว่าเตรียมก๊าซ H2 จากสมการ I จำนวน 2.24 dm3
ที่ STP สิ่งที่โจทย์ต้องการทราบคือ ถ้าเตรียมก๊าซ H2 จำนวน 2.24 dm3 ที่ STP เท่าเดิม แต่เตรียมจากสมการ II แล้วให้คำนวณว่าจะต้องใช้ Mg กี่กรัม (H=1 O=16 S=32
Zn=65)
ขั้นแรกเราพิจารณาที่สมการ I เสียก่อน จะเห็นว่าจำนวนโมลของ Zn ที่ใช้ เท่ากับจำนวนโมลของ H2 ที่ได้
ขณะนี้โจทย์กำหนดปริมาณของ H2 = 2.24 dm3 ที่ STP เปลี่ยนให้เป็นจำนวนโมล ดังนี้
ถ้ามี H2 จำนวน 22.4 dm3 ที่ STP คิดเป็นโมลได้ 1 โมล
ถ้ามี H2 จำนวน 2.24 dm3 ที่ STP คิดเป็นโมลได้ 2.24/22.4 = 0.10 โมล
จากสมการ จำนวนโมลของ Zn ที่ใช้ = จำนวนโมลของ H2 ที่ได้
= 0.10 โมล
เปลี่ยนเป็นน้ำหนัก (กรัม)
ถ้ามี Zn จำนวน 1 โมล จะมีน้ำหนัก 65 กรัม
ถ้ามี Zn จำนวน 0.1 โมล จะมีน้ำหนัก 65 x 0.1 = 6.50 กรัม ตอบ
ใช้สูตร

ขั้นต่อไปพิจารณาที่สมการ II ต้องการผลิตก๊าซ H2 เท่ากับที่ผลิตจากสมการที่ I ก็คือ 2.24 dm3 ซึ่งคิดมาแล้วว่าคือ 0.10 โมล คราวนี้ต้องการหาน้ำหนักของ Mg
ซึ่งจะเห็นว่าจำนวนโมลของ Mg ที่ใช้ เท่ากับจำนวนโมลของ H2 ที่ได้
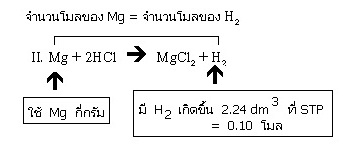
จากสมการ จำนวนโมลของ Mg ที่ใช้ = จำนวนโมลของ H2 ที่ได้
= 0.10 โมล
คิดเป็นน้ำหนัก (กรัม)
ถ้ามี Mg จำนวน 1 โมล จะหนัก = 24 กรัม
ถ้ามี Mg จำนวน 0.1 โมล จะหนัก = 24 x 0.1 กรัม
= 2.40 กรัม ตอบ
ใช้สูตร
W/M = V/22.4
W/Mg = V/22.4
W/24 = 2.4/22.4
W = 2.40 กรัม ตอบ
แบบฝึกหัด
1. ในการเผา KClO3 6.125 กรัม จะได้แก๊สออกซิเจนเท่ากับการเผา KMnO4 กี่กรัม (K=39 Mn=55 Cl=35.5 )
2KClO3 → 2KCl + 3O2
2KMnO4 → K2MnO4 + MnO2 + O2
1. 5.92 2. 7.90 3. 10.53 4. 23.70
2. จะต้องใช้ Zn กี่กรัม ทำปฏิกิริยากับ H2SO4 จึงจะเกิดแก๊ส H2 ปริมาตรเท่ากับเมื่อใช้ Na 4.6 กรัม และปริมาตรแก๊ส H2 ที่เกิดขึ้นเป็นกี่ cm3 ที่ STP
(Zn=65 S=32 Na=23 O=16)
1. 13.00 g , 2,240 cm3 2. 13.00 g , 4,480 cm3
3. 6.50 g , 2,240 cm3 4. 6.50 g , 4,480 cm3
3. ใช้ผงสังกะสี 0.40 โมล ทำปฏิกิริยากับสารละลาย Cu2+ ความเข้มข้น 0.1 mol/dm3 จำนวน 400 cm3 เมื่อปฏิกิริยาสิ้นสุดพบว่ามีสังกะสีเหลืออยู่จำนวนหนึ่ง
จึงเติมสารละลายกรดซัลฟูริกความเข้มข้น 6 mol/dm3 ลงไปจนทำปฏิกิริยากับสังกะสีส่วนที่เหลือทั้งหมด หลังจากปฏิกิริยาเกิดขึ้นโดยสมบูรณ์แล้ว จงพิจารณาว่าข้อใดถูกต้อง
(Cu=63.5 Zn=65 S=32 O=16 H=1)
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Zn(s) + H2SO4 → ZnSO4(aq) + H2(g)
I. จำนวนโมลของ H2 ที่เกิดขึ้นทั้งหมด = 0.36 โมล
II. ความเข้มข้นของ Zn2+ ก่อนเติมสารละลายกรดซัลฟูริกคือ 0.1 mol/dm3
III. ปริมาตรของสารละลายกรด H2SO4 ที่เติมลงไป = 60 cm3
IV. โลหะ Cu ที่เกิดขึ้นมีน้ำหนัก 2.54 กรัม
1. I 2. I II 3. I II III 4. I I III IV
4. เมื่อสารละลาย HNO3 ความเข้มข้น 3.0 mol/dm3 ทำปฏิกิริยากับทองเหลือง 15 กรัม (ทองเหลืองประกอบด้วย Cu 90 % Zn 10 %) เกิดปฏิกิริยาดังสมการ
(Cu=63.5 N=14 O=16 Zn=65)
Cu(s) + HNO3(aq) → 2NO2(g) + Cu(NO3)2 + 2H2O
4Zn(s) + 10HNO3(aq) → NH4NO3(aq) + 4Zn(NO3)2 + 3H2O
จงพิจารณาว่าข้อความต่อไปนี้ข้อใดถูกต้อง
1. จำนวนอะตอมของ Cu ในทองเหลือง = 13.5 x 6.02 x 1023 อะตอม
2. ปริมาตรของ HNO3 ที่สามารถทำปฏิกิริยาพอดีกับทองเหลืองจำนวนนี้เท่ากับ 303 cm3
3. จำนวนโมเลกุลของแก๊ส NO2 ที่เกิดขึ้นเท่ากับ 2 x 6.02 x 1023 โมเลกุล
4. จำนวนโมลของ HNO3 ที่ใช้ทำปฏิกิริยาที่ 2 = 0.05 โมล
5. เมื่อนำสารละลาย AgNO3 ความเข้มข้น 1 mol/dm3 จำนวน 100 cm3 มาทำปฏิกิริยากับสารละลาย BaCl2 ความเข้มข้น 1 mol/dm3 จำนวน 60 cm3
เมื่อเกิดปฏิกิริยาสมบูรณ์กรองตะกอนที่เกิดขึ้นออกไป นำส่วนที่เป็นของเหลวมาทำปฏิกิริยากับกรดซัลฟิวริกความเข้มข้น 1 mol/dm3 จะต้องใช้สารละลายกรดซัลฟิวริกกี่ cm3
จึงจะเกิดปฏิกิริยาอย่างสมบูรณ์ (Ag=108 O=16 N=14 Ba=137 Cl=35.5)
1. 10 2. 40 3. 50 4. 60
6. เมื่อนำของผสมระหว่าง MgCO3 กับ CaCO3 หนัก 13 กรัม มาทำปฏิกิริยากับกรด HCl ที่มากเกินพอ วัดปริมาตรของก๊าซ CO2 ที่เกิดขึ้นที่ภาวะมาตรฐานได้เป็น 3.36 dm3
ร้อยละโดยมวลของ MgCO3 ในของผสมเป็นเท่าไร (Mg=24 Ca=40 Cl=35.5 O=16 C=12 H=1)
1. 19.3 2. 40.4 3. 59.6 4. 80.7
7. (คัดเลือกเคมีโอลิมปิค. 43) ก๊าซผสม C2H6 C3H8 C4H10 ที่มีจำนวนโมลเท่ากัน น้ำหนักรวมเท่ากับ 26.4 กรัม จะต้องใช้ก๊าซออกซิเจนกี่กรัม จึงจะทำปฏิกิริยาเผาไหม้
ก๊าซผสมนี้ได้อย่างสมบูรณ์(ตอบ 4)
1. 32 2. 48 3. 64 4. 96
8. (คัดเลือกเคมีโอลิมปิค. 43) สารละลายกรด 100 cm3 มี HCl 0.01 mol ผสมกับ H2SO4 0.02 mol เมื่อนำมาทำปฏิกิริยากับ Na2CO3 ความเข้มข้น 0.10 โมล/ลิตร
จนสารละลายเป็นกลาง จะต้องใช้ Na2CO3 กี่ cm3 (ตอบ 2)
1. 200 2. 250 3. 300 4. 400
9. (คัดเลือกเคมีโอลิมปิค. 43) เมื่อเผา S 4.8 กรัม อย่างสมบูรณ์ ได้ก๊าซที่มีน้ำหนักเป็น 2 เท่าของ S ที่ใช้ และเมื่อเผาสารประกอบไฮโดรคาร์บอน X ด้วยออกซิเจนปริมาณ
เท่ากับที่ใช้เผา S ข้างต้น จะได้ก๊าซ CO2 672 cm3 ที่ STP สารประกอบ X มีสูตรโมเลกุลอย่างไร (S=32 O=16 C=12 H=1)
1. CH4 2. C2H6 3. C3H8 4. C4H10
10. (คัดเลือกเคมีโอลิมปิค. 45) แร่ชนิดหนึ่งมีสูตร Na2CO3.NaHCO3.2H2O ถ้านำแร่ตัวอย่างนี้มา 0.452 กรัม จะต้องใช้สารละลาย HCl ความเข้มข้น 0.125 M
จำนวนกี่ cm3 จึงจะเปลี่ยนคาร์บอเนตและไฮโดรเจนคาร์บอเนตให้เป็น CO2 และ H2O ทั้งหมด (Cl=35.5 Na=23 O=16 C=12 H=1)
1. 48.0 2. 32.0 3. 19.0 4. 16.0
11. (คัดเลือกเคมีโอลิมปิค. 42) เมื่อเผา S หนัก 4.8 กรัม อย่างสมบูรณ์จะได้ก๊าซที่มีน้ำหนักเป็น 2 เท่าของน้ำหนักของ S ที่ใช้ และเมื่อเผาสารประกอบไฮโดรคาร์บอน X
ด้วยออกซิเจนปริมาณเท่ากับที่ใช้เผา S ข้างต้น จนกลายเป็น CO2 หมด ปรากฏว่าได้ก๊าซ CO2 672 cm3 ที่ STP สารประกอบ X มีสูตรโมเลกุลอย่างไร (S=32 O=16 C=12)
1. CH4 2. C2H6 3. C3H6 4. C4H10
12. (A-Net มี.ค. 49) ผสมแก๊ส C2H4 และ C2H6 ในสัดส่วนจำนวนโมลเท่ากัน หนัก 5.8 กรัม ให้ทำปฏิกิริยาเผาไหม้กับแก๊ส O2 อย่างสมบูรณ์ จะต้องใช้แก๊ส O2
อย่างน้อยกี่กรัม
1. 6.5 2. 11.6 3. 20.8 4. 41.6
13. (PAT 2 มี.ค. 52) มีสารละลายกรด 2 ชนิดผสมกันอยู่ คือกรด H2SO4 เข้มข้น 0.1 โมลาร์ ปริมาตร 60 มิลลิลิตร และกรด HCl เข้มข้น 0.2 โมลาร์
ปริมาตร 50 มิลลิลิตร จะต้องเติมสารละลายเบส NaOH ที่มีความเข้มข้น 0.4 โมลาร์ จำนวนเท่าใดจึงจะทำปฏิกิริยาพอดีกับกรดผสมทั้งหมดนั้น
1. 40 มิลลิลิตร 2. 45 มิลลิลิตร 3. 50 มิลลิลิตร 4. 55 มิลลิลิตร
14. (A-NET 50) สารละลาย NH3 ที่ต้องการหาความเข้มข้น ปริมาตร 25 cm3 เมื่อทำปฏิกิริยากับสารละลาย HCl เข้มข้น 0.1 mol/dm3 ที่มากเกินพอ ปริมาตร 40 cm3
พบว่าปริมาณ HCl ที่เหลือ ทำปฏิกิริยาพอดีกับสารละลาย NaOH เข้มข้น 0.05 mol/dm3 ปริมาตร 20 cm3 ความเข้มข้นของสารละลาย NH3 มีค่ากี่โมลต่อลูกบาศก์เดซิเมตร
1. 0.08 2. 0.12 3. 0.26 3. 0.35
15. (A-NET 50) เติมสารละลาย KOH เข้มข้น 0.15 mol/dm3 ปริมาตร 80 cm3 ลงในสารละลายกรดอ่อน HA ปริมาตร 25 cm3 แล้วนำสารละลายที่ได้ไปทำปฏิกิริยา
กับสารละลาย HCl เข้มข้น 0.2 mol/dm3 ต้องใช้สารละลาย HCl ปริมาตร 22.50 cm3 จึงจะทำปฏิกิริยาพอดี สารละลายกรดอ่อน HA มีความเข้มข้นกี่โมล/ลูกบาศก์เดซิเมตร
1. 0.15 2. 0.20 3. 0.25 4. 0.30
16. ใส่ผงสังกะสี 6.5 กรัมและผงแมกนีเซียมอีก 2.4 กรัม ลงในสารละลาย HCl ที่มากเกินพอ รอจนกระทั่งปฏิกิริยาสิ้นสุด จะมีแก๊ส H2 เกิดขึ้นกี่ dm3 ที่ STP
(Zn=65 Mg=24 H= 1 Cl=35.5)
Zn + HCl → ZnCl2 + H2
Mg + HCl → MgCl2 + H2
1. 4.48 2. 2.24 3. 1.12 4. 0.56
17. มีสารละลายกรด H2SO4 ความเข้มข้น 0.1 โมล/ลิตร จำนวน 1 ลิตร เติมสารละลาย KOH ความเข้มข้น 0.1 โมล/ลิตร ลงไปจำนวน 1 ลิตร
จากนั้นจึงใส่ผงสังกะสีลงไปอีกจนเกิดปฏิกิริยาอย่างสมบูรณ์ อยากทราบว่าผงสังกะสีที่ใส่ลงไปมีน้ำหนักกี่กรัม (Zn=65 K=39 S=32 O=16)
H2SO4 + KOH → K2SO4 + H2O
Zn + H2SO4 → ZnSO4 + H2
1. 32 กรัม 2. 3.2 กรัม 3. 0.32 กรัม 4. 0.032 กรัม
18. ของผสมระหว่าง CaCO3 กับ Na2CO3 มีจำนวนโมลเท่ากัน และมีน้ำหนักรวมกันเท่ากับ 20.6 กรัม เมื่อให้ของผสมนี้ทำปฏิกิริยากับสารละลายกรด HCl
ความเข้มข้น 0.1 mol/dm3 เพื่อให้เกิดปฏิกิริยาอย่างสมบูรณ์ จะต้องใช้สารละลายกรด HCl กี่ cm3 (Ca=40 C=12 O=16 Na=23 H=1 Cl=35.5)
CaCO3 + HCl → CaCl2 + H2O + CO2
Na2CO3 + HCl → NaCl + H2O + CO2
1. 40 2. 400 3. 4,000 4. 8,000
19. จากข้อ 18 จะมีก๊าซ CO2 เกิดขึ้นกี่ dm3
1. 0.448 2. 4.48 3. 0.224 4. 2.24
20. ถ้าก๊าซหุงต้ม (LPG) ประกอบด้วยโพรเพน (C3H8) และบิวเทน (C4H10) ในอัตราส่วนร้อยละ 80:20 โดยมวลตามลำดับ เมื่อนำก๊าซหุงต้ม 510 กรัม
มาทำให้เกิดการเผาไหม้อย่างสมบูรณ์ จะต้องใช้ก๊าซ O2 กี่ dm3 ที่ STP และจะมีก๊าซ CO2 เกิดขึ้นกี่กรัม
C3H8 + O2 → CO2 + H2O
C4H10 + O2 → CO2 + H2O
1. 1,294 dm3 , 1,533 g 2. 257 dm3 , 308 g
3. 112 dm3 , 510 g 4. 257 dm3 , 610 g
21. ผู้ใช้รถยนต์มีความเชื่อกันว่าการใช้ก๊าซ NGV หรือ CNG (CH4) เป็นเชื้อเพลิง จะทำให้เกิดความร้อนมากกว่าการใช้ก๊าซหุงต้มหรือ LPG ถ้าก๊าซหุงต้มประกอบด้วย
โพรเพน (C3H8) เพียงอย่างเดียว อยากทราบว่าเมื่อใช้ก๊าซ NGV และ LPG ชนิดละ 500 กรัม ชนิดใดจะให้ความร้อนมากกว่ากันเท่าไร
CH4 + O2 → CO2 + H2O
C3H8 + O2 → CO2 + H2O
กำหนดพลังงานพันธะหน่วยเป็น kJ/mol ให้ดังนี้
C-C = 348 C-H = 413 O=O = 498 C=O = 745 O-H = 436
22. มนุษย์ใช้พลังงานในการดำรงชีวิตอย่างสะดวกสบายเทียบเท่ากับการเผาไหม้ CH4 และเกิด CO2 ประมาณ 250 โมลต่อวัน ส่วนต้นไม้สามารถเปลี่ยน CO2
ให้เป็นเซลลูโลส ซึ่งมีสูตรโมเลกุล (C12H22O11)10 ได้ตามสมการ CO2 + H2O è (C12H22O11)10 + O2 (สมการยังไม่ดุล)
ถ้าต้นไม้ 1 ต้น และคน 1 คน มีอายุเฉลี่ยเป็น 80 ปี เท่ากัน โดยต้นไม้สร้างเซลลูโลสได้ 5 kg ต่อปี ถ้าต้องการให้ปริมาณ CO2 ในโลกคงที่ ชั่วชีวิตคน 1 คน
ควรปลูกต้นไม้โดยเฉลี่ยกี่ต้น (ตัวเลขจำนวนเต็ม) ทั้งนี้กำหนดให้ 1 ปี มี 365 วัน
เฉลย
1.4 2.3 3.4 4.4 5.1 6.4 7.4 8.2 9.3 10.1
11.3 12.3 13.4 14.2 15.4 16.1 17.2 18.3 19.2 20.
21.
Appendix
1. Yellow brass mixed from zinc and copper 70:30 percent by mass , if 80 grams of yellow brass react with excess HNO3 , calculate
how many grams of HNO3 for this reaction, the reaction as follow.
Zn + HNO3 → Zn(NO2)3 + H2
Cu + HNO3 → Cu(NO3)2 + NO + H2O
* ทองเหลืองประกอบด้วยสังกะสีกับทองแดง อัตราส่วนร้อยละ 70:30 โดยมวล เมื่อทองเหลือง 80 กรัมทำปฏิกิริยากับ HNO3 ที่มากเกินพอ จะหาน้ำหนักของ HNO3 ที่ใช้
ปฏิกิริยาที่เกิดขึ้นเป็นดังนี้*
2. LPG gas consists of C3H8 and C4H10 , 70 to 30 percent by mass, when the burning of 1.0 kg of LPG gas completely;
2.1 How many dm3 of CO2 happened at STP?
2.2 How many grams of O2 for combustion of this LPG . Use the following equation; (Equations do not balance.)
C3H8 + O2 → CO2 + H2O
C4H10 + O2 → CO2 + H2O
* ก๊าซ LPG ประกอบด้วย C3H8 และ C4H10 ร้อยละ 70:30 โดยมวล เมื่อเผาไหม้ก๊าซ LPG 140 กรัม อย่างสมบูรณ์ ; 2.1 จะมีก๊าซ CO2 เกิดขึ้นกี่ dm3 ที่ STP
2.2 จะต้องใช้ O2 กี่กรัมในการเผาไหม้ ; ใช้สมการ(ยังไม่ดุล)ต่อไปนี้ *
3. A mixture of CaCO3 and MgCO3 are combined weight 140 grams, react with excess of HCl , If 11.10 g CaCl2 occurred, What is the weight (g) of
MgCO3 and how mamy grams of all CO2 occurred?. Use the following equation; (Equations do not balance.)
CaCO3 + HCl → CaCl2 + H2O + CO2
MgCO3 + HCl → MgCl2 + H2O + CO2
* ของผสมระหว่าง CaCO3 กับ MgCO3 มีน้ำหนักรวมกัน 140 กรัม ทำปฏิกิริยากับกรด HCl ที่มากเกินพอ พบว่ามี CaCl2 เกิดขึ้น 11.10 กรัม จงหาน้ำหนักของ MgCO3
ในของผสมและหาน้ำหนักของ CO2 ที่เกิดขึ้นทั้งหมด ใช้สมการ(ยังไม่ดุล)ต่อไปนี้ *
4. Gasohol octane number 91, consists of C8H18 (octane) and ethanol (C2H5OH) 91:9 percent by mass respectively. If 100 g of gasohol burning
completely, how many grams of oxygen gas will require and how many grams of CO2 are formed. Use the following chemical equation.
C8H18 + 12.5O2 → 8CO2 + 9H2O
C2H5OH + 3O2 → 2CO2 + 3H2O
* น้ำมันแก๊สโซฮอล์ ออกเทน 91, ประกอบด้วย C8H18 (octane) และ เอทานอล(C2H5OH) ร้อยละ 91:9 โดยมวล ตามลำดับ ถ้ามีการเผาไหม้น้ำมันชนิดนี้ 100 กรัม
อย่างสมบูรณ์ จะต้องใช้ก๊าซออกซิเจนทั้งหมดกี่กรัม และเกิดก๊าซ CO2 กี่กรัม ใช้สมการเคมีดังต่อไปนี้
5. Gasohol octane number 95, consists of C8H18 (octane) and ethanol (C2H5OH) 95:5 percent by mass respectively. If 100 g of gasohol burning
completely, how many grams of oxygen gas will require and how many grams of CO2 are formed. Use the following chemical equation.
C8H18 + 12.5O2 → 8CO2 + 9H2O
C2H5OH + 3O2 → 2CO2 + 3H2O
* น้ำมันแก๊สโซฮอล์ ออกเทน 95 ประกอบด้วย C8H18 (octane) และ เอทานอล(C2H5OH) ร้อยละ 95: 5โดยมวล ตามลำดับ ถ้ามีการเผาไหม้น้ำมันชนิดนี้ 100 กรัม
อย่างสมบูรณ์ จะต้องใช้ก๊าซออกซิเจนทั้งหมดกี่กรัม และเกิดก๊าซ CO2 กี่กรัม ใช้สมการเคมีดังต่อไปนี้*
6. Gasohol E85 consists of octane (C8H18) and ethanol (C2H5OH) in a 15:85 ratio by mass percent, respectively, if 100 grams of this oil burns
completely. How many grams of oxygen must be used and how many grams of CO2 occurs. Reaction occurs as follows.
C8H18 + 12.5O2 → 8CO2 + 9H2O
C2H5OH + 3O2 → 2CO2 + 3H2O
*น้ำมันแก๊สโซฮอล์ E85 ประกอบด้วย ออกเทน (C8H18) และ เอทานอล (C2H5OH) ในอัตราส่วนร้อยละโดยมวล 15:85 ตามลาดับ ถ้าเผาไหม้น้ำมันนี้ 100 กรัมอย่างสมบูรณ์
จะต้องใช้ออกซิเจนกี่กรัมและมี CO2เกิดขึ้นกี่กรัม
รูปภาพที่เกี่ยวข้อง

Size : 38.47 KBs
Upload : 2013-08-07 05:58:54
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|