ของแข็ง ของเหลว แก๊ส (ตอนที่ 1) สถานะของสารและวัฏภาค (State and Phase)
ของแข็ง ของเหลว แก๊ส
วัตถุหรือสารส่วนมากมีสถานะได้ 3 สถานะ คือ ของแข็ง ของเหลวและแก๊สหรือไอ สาเหตุที่ทำให้สารมีสถานะต่างกันก็คือพลังงานจลน์ (Kinetic energy) ของอนุภาคของสารเหล่านั้น ถ้าอนุภาคมีพลังงานจลน์ต่ำจนไม่สามารถเคลื่อนที่ได้ (แต่สั่นสะเทือนได้) สารจะมีสถานะเป็นของแข็ง (คลิ้กชมอนุภาคของสารขณะเป็นของแข็ง) ถ้าอนุภาคมีพลังงานจลน์สูงขึ้นจนเคลื่อนที่ไปมาได้แต่ยังไม่เป็นอิสระเพราะยังมีแรงดึงดูดกับอนุภาคที่อยู่รอบ ๆ สารจะมีสถานะเป็นของเหลว (คลิ้กชมอนุภาคของสารขณะเป็นของเหลว) แต่ถ้าอนุภาคมีพลังงานสูงมากจะเอาชนะแรงดึงดูดจากอนุภาคที่อยู่รอบ ๆ จนทำให้เคลื่อนที่ได้อย่างอิสระ สารก็จะมีสถานะเป็นแก๊สหรือไอ (คลิ้กชมอนุภาคของสารขณะเป็นแก๊ส) (คลิ้กชมโมเลกุลของน้ำที่สถานะต่าง ๆ) (คลิ๊กอ่านคำอธิบายสมบัติเบื้องต้นของของแข็ง ของเหลว และแก๊ส)
ความแตกต่างของสถานะอาจกล่าวได้ในอีกรูปแบบหนึ่งว่าต่างวัฎภาค (Phase) กัน แต่คำว่าวัฏภาคกับคำว่าสถานะ (state) มีความแตกต่างกัน คือสถานะเป็นการระบุสมบัติทางกายภาพตามที่ปรากฏ ว่าเป็นของแข็ง หรือของเหลวหรือแก๊ส เป็นการกล่าวถึงอย่างรวม ๆ ว่าเมื่อเป็นสถานะใดแล้วก็จะเหมือนกันทั้งที่ความจริงแล้วมีความแตกต่างกัน เช่น น้ำเป็นของเหลว ถ้ามองเพียงว่าเป็นของเหลวก็จะเห็นว่าเหมือนกัน ทั้งที่ความจริงแล้วมันต่างกันได้ที่อุณหภูมิและความดัน ถ้าใช้คำว่าวัฏภาค จะหมายถึงการระบุถึงส่วนของระบบที่มีสถานะเดียวกันซึ่งสัมผัสอยู่กับส่วนอื่น ๆ ที่มีสถานะต่างกันโดยมีแนวกั้นที่ชัดเจน สถานะจะสัมพันธ์กับอุณหภูมิและความดัน ดังรูปต่อไปนี้เป็นแผนผังแสดงวัฏภาคของน้ำ ซึ่งประกอบด้วยสถานะทั้ง 3 ของน้ำ คือ ของแข็ง (น้ำแข็ง) ของเหลว และ แก๊สหรือไอน้ำ โดยมีเส้นแบ่งระหว่างสถานะแต่ละสถานะแสดงเอาไว้ แสดงให้เห็นได้ว่าแต่ละสถานะเกิดขึ้นได้ที่อุณหภูมิและความดันเท่าไร แต่ละส่วนที่อยู่คนละด้านของเส้นแบ่ง ก็คือน้ำที่อยู่ต่างวัฏภาคกัน ฉะนั้นวัฏภาคจึงเป็นขอบเขตแสดงสถานะของสารแต่ละชนิดที่มีอุณหภูมิและความดันต่าง ๆ กัน ดังรูป
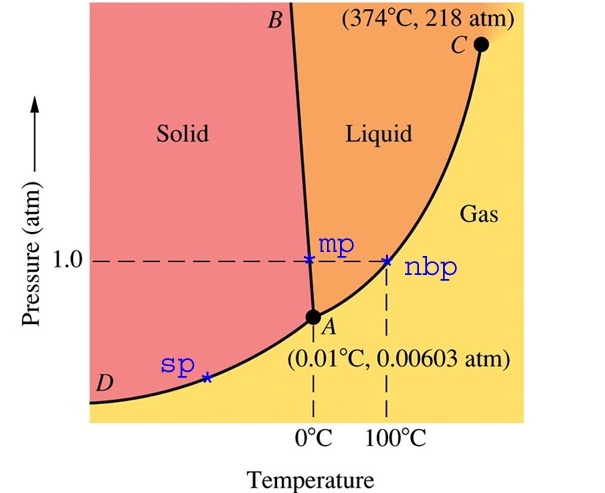
จุดสำคัญของแผนผังวัฏภาคมีดังนี้
1. จุดใดก็ได้บนแนวเส้นแบ่งของวัฏภาค เป็นจุดที่แสดงอุณหภูมิและความดันที่ทำให้สารกำลังเปลี่ยนสถานะจากสถานะหนึ่งไปเป็นอีกสถานะหนึ่ง ฉะนั้น ณ จุดบนเส้นแบ่งวัฏภาค สารจะมีทั้ง 2 สถานะอยู่พร้อมกัน ถ้าอุณหภูมิและความดันคงที่ จะเป็นภาวะสมดุลระหว่างสถานะทั้งสอง หมายความว่า ณ จุดนั้นจะมีการเปลี่ยนสถานะทั้ง 2 อย่างเกิดขึ้นด้วยอัตราเร็วเท่ากัน ถ้าข้ามไปด้านหนึ่งก็จะเป็นสถานะหนึ่ง ถ้าข้ามกลับมาก็จะเป็นอีกสถานะหนึ่ง ดังรูป
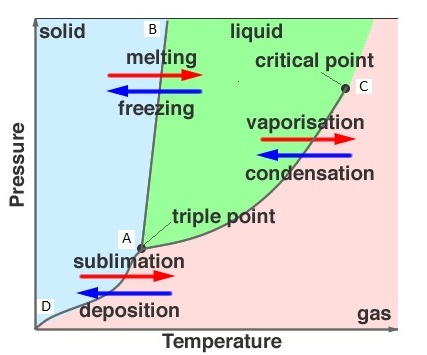
2. ระหว่าง A ถึง D แสดงอุณหภูมิและความดันของการระเหิด (sp = sublimation point) และกระบวนการย้อนกลับของการระเหิด (Deposition) หมายความว่าทุกจุดบนเส้น AD เป็นอุณหภูมิและความดันที่ทำให้ระเหิดและการย้อนกลับของการระเหิดได้ทั้งสิ้น ให้สังเกตว่าอุณหภูมิและความดันของการระเหิดและการย้อนกลับของการระเหิดจะแปรผันตรงซึ่งกันและกัน คือถ้าความดันต่ำอุณหภูมิของการระเหิดและการย้อนกลับของการระเหิดก็ต่ำ ถ้าความดันสูงอุณหภูมิของการระเหิดและการย้อนกลับของการระเหิดก็สูง
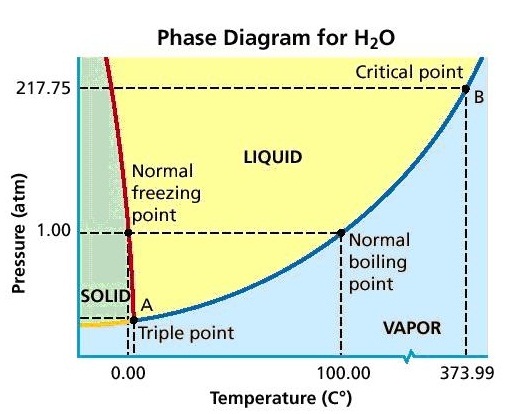
3. ระหว่าง A ถึง B แสดงอุณหภูมิและความดันของการหลอมเหลว ( mp = melting point) และการแข็งตัว (Freeze) หมายความว่าทุกจุดบนเส้น AB เป็นอุณหภูมิและความดันที่ทำให้หลอมเหลวและแข็งตัว ได้ทั้งสิ้น ความสัมพันธ์ระหว่างอุณหภูมิกับความดันของการหลอมเหลวและการแข็งตัวของสารแต่ละชนิดอาจมีรูปแบบแตกต่างกัน คือ สารบางชนิดแปรผันตรง บางชนิดแปรผกผัน บางชนิดไม่แปรผันและไม่แปรผกผัน เช่น น้ำจะเป็นแบบแปรผกผัน คือเมื่อความดันเพิ่มขึ้นจุดเยือกแข็งหรือจุดหลอมเหลวจะลดลง ดังรูป
ก๊าซคาร์บอนไดออกไซด์เป็นแบบแปรผันตรง คือจุดหลอมเหลวหรือจุดเยือกแข็งจะเพิ่มขึ้นเมื่อความดันเพิ่มขึ้น ดังรูป
แต่สำหรับเบนซีน จุดหลอมเหลวหรือจุดเยือกแข็งไม่ขึ้นกับความดัน คือไม่ว่าความดันจะเพิ่มขึ้นหรือลดลง จุดหลอมเหลวหรือจุดเยือกแข็งจะคงที่ ดังรูป

4. ระหว่าง A ถึง C เป็นภาวะของการเดือด(ระเหยพร้อมกันทุกส่วน) และการควบแน่น (bp = boiling point) หมายความว่าทุกจุดบนเส้น AC เป็นอุณหภูมิและความดันที่ทำให้ของเหลวเดือดและควบแน่นได้พร้อมกัน แต่มีอุณหภูมิและความดันต่าง ๆ กัน ให้สังเกตว่าเมื่อความดันเพิ่มขึ้นจุดเดือดก็จะเพิ่มขึ้นด้วย มีข้อกำหนดให้เรียกจุดเดือดที่ความดัน 1 atm ว่าจุดเดือดปกติ (nbp = normal boiling point)
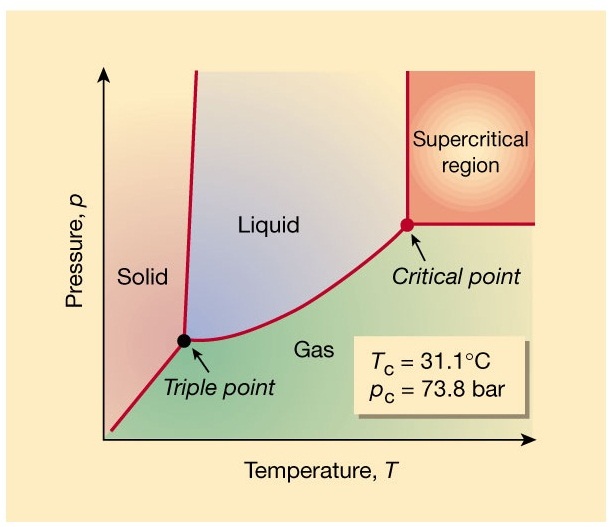
5. จุดร่วมสาม , Triple point, A คือ คืออุณหภูมิและความดันที่จะทำให้น้ำ (สาร) ทั้ง 3 สถานะคือของแข็ง ของเหลวและแก๊ส อยู่ร่วมกันในเวลาเดียวกันได้ (กรณีของน้ำจะอยู่ที่อุณหภูมิ 0.01 oC ความดัน 0.00603 atm) สารแต่ละชนิดจะมีอุณหภูมิและความดัน ณ จุดร่วมสามเฉพาะตัว
6. จุดวิกฤติ, Critical point , C คือ จุดที่แสดงอุณหภูมิและความดันสูงสุดที่จะทำให้สารมีสถานะเป็นของเหลวและไอหรือแก๊สพร้อมกันได้ สำหรับกรณีของน้ำจุดวิกฤติอยู่ที่อุณหภูมิ 374 oC ความดัน 218 atm หมายความว่า ถ้าอุณหภูมิและความดันสูงกว่านี้น้ำและไอน้ำอยู่พร้อมกันไม่ได้ จะกลายเป็นสิ่งที่เรียกว่า super critical fluid , SCF ,ของเหลวยิ่งยวด คือเป็นของเหลวที่ไหลได้โดยไม่มีแรงเสียดทาน (คลิ้ก super critical fluid)
ชมการแสดงว่าจุดหลอมเหลวกับจุดเยือกแข็งคืออุณหภูมิเดียวกัน
ชม Phase Diagram ชม Phase transition
คำถาม จากแผนผังวัฏภาคของแก๊สคาร์บอนไดออกไซด์ต่อไปนี้
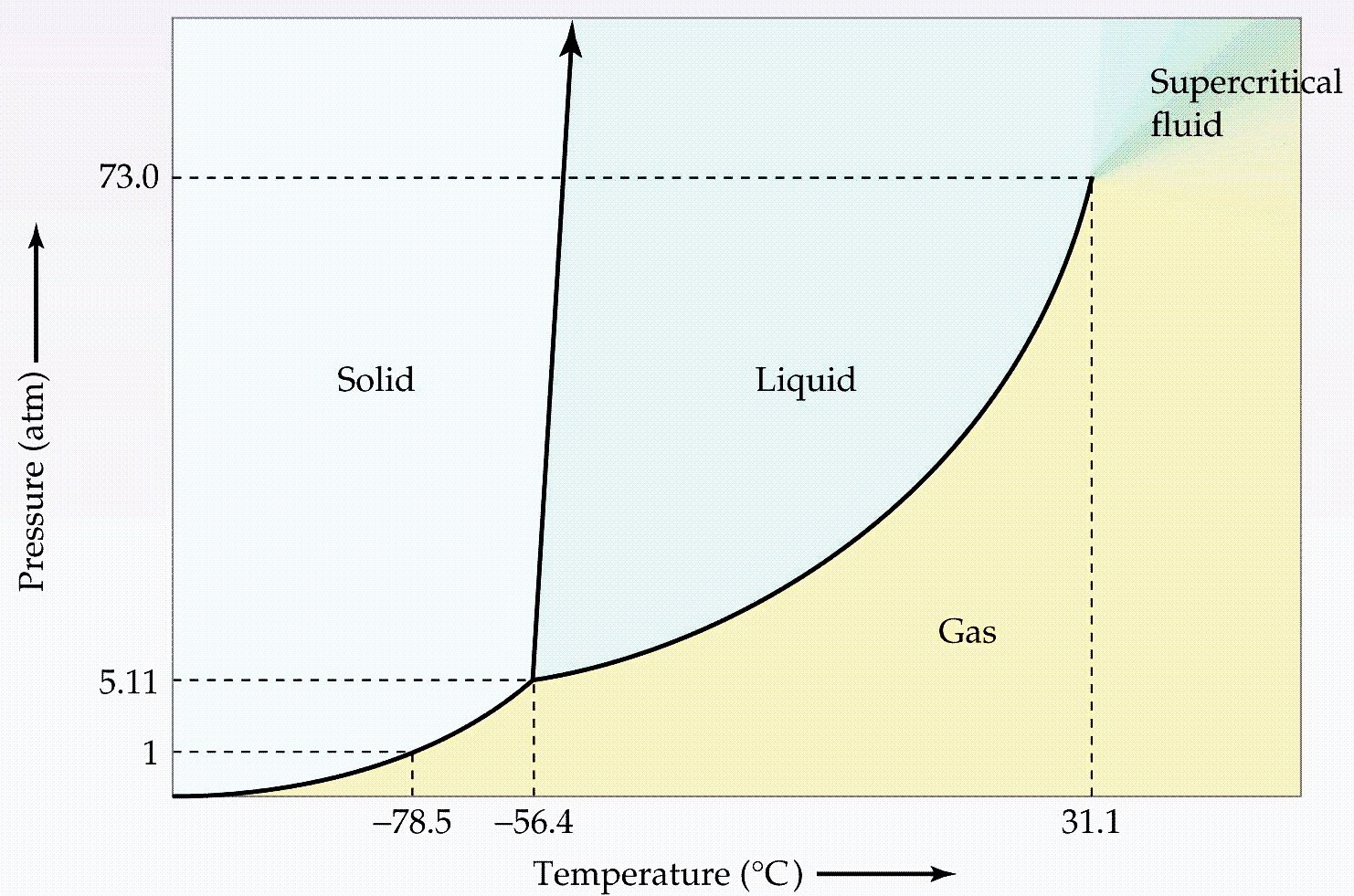
จงตอบคำถาม
- มีจุดเดือดปกติหรือไม่เพราะเหตุใด
......................................................................................................................................................
- อุณหภูมิและความดันเท่าไรที่ทำให้คาร์บอนไดออกไซด์อยู่ได้ทั้ง 3 สถานะพร้อมกัน
.....................................................................................................................................................
- การระเหิดของแก๊สคาร์บอนไดออกไซด์จะเกิดขึ้นในช่วงอุณหภูมิและความดันเท่าไร
.....................................................................................................................................................
- จุดเยือกแข็งหรือจุดหลอมเหลวของคาร์บอนไดออกไซด์สัมพันธ์กับอุณหภูมิและความดันอย่างไร
...................................................................................................................................................
- แก๊สคาร์บอนไดออกไซด์จะไม่สามารถเป็นของเหลวและแก๊สได้อีก ณ อุณหภูมิและความดันเท่าไร
..................................................................................................................................................
รูปภาพที่เกี่ยวข้อง

Size : 48.41 KBs
Upload : 2014-02-08 20:05:53
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|