ของแข็ง ของเหลว แก๊ส (ตอนที่ 5) กฎของบอยล์
กฎของแก๊ส
มีนักวิทยาศาสตร์จำนวนมากที่สนใจและศึกษาสมบัติของแก๊ส โดยเป็นการศึกษาเกี่ยวกับความสัมพันธ์ระหว่าง จำนวนโมล อุณหภูมิ ความดัน และปริมาตร ของแก๊สในรูปแบบต่าง ๆ กำหนดให้
n = จำนวนโมลของแก๊ส
T = อุณหภูมิของแก๊ส (เคลวิน ,K)
P = ความดันของแก๊ส
V = ปริมาตรของแก๊ส
กฎของบอยล์ (Boyle,s law) (ค.ศ. 1662 พ.ศ.2205)
ค.ศ. 1662 (พ.ศ. 2205 สมัยกรุงศรีอยุธยา) รอเบิร์ต บอยล์ (Robert Boyle) นักเคมีชาวอังกฤษ ศึกษาความสัมพันธ์ระหว่างปริมาตรกับความดันของแก๊สที่มีจำนวนโมล (หรือมวล) และอุณหภูมิคงที่ ได้ผลการทดลองเรียกว่า “กฎของบอยล์” ดังนี้ เมื่อจำนวนโมล (หรือมวล )และอุณหภูมิของแก๊สคงที่ ปริมาตรของแก๊สจะแปรผกผัน (varies Inversely) กับความดัน และผลคูณระหว่างปริมาตรกับความดันเป็นค่าคงที่ ; PV = k

ตัวอย่างผลการทดลอง (แก๊สมีจำนวนโมลและอุณหภูมิคงที่)
|
การทดลอง
ครั้งที่
|
ปริมาตร
(V , dm3)
|
ความดัน
(P , mmHg)
|
PV
(mmHg. cm3)
|
|
1
|
5.00
|
760
|
3.80 x 103
|
|
2
|
10.00
|
380
|
3.80 x 103
|
|
3
|
15.00
|
253
|
3.80 x 103
|
|
4
|
20.00
|
191
|
3.82 x 103
|
|
5
|
25.00
|
151
|
3.78 x 103
|
|
6
|
30.00
|
127
|
3.81 x 103
|
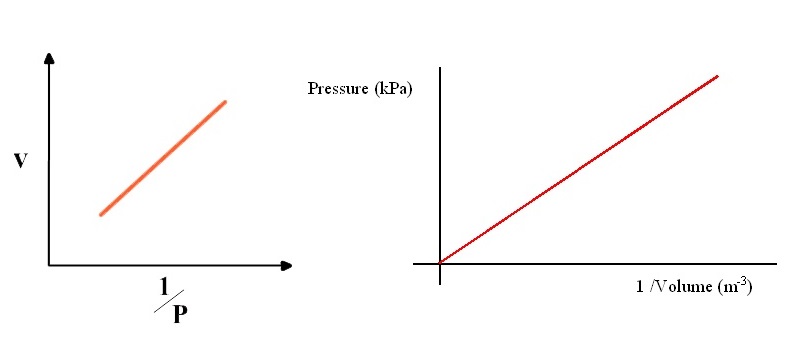
จากตัวอย่างผลการทดลองจะเห็นได้ว่าปริมาตร (V) กับความดัน (P) ของแก๊สจะเปลี่ยนแปลงไปในทางตรงกันข้าม เรียกว่าแปรผกผันกัน ( varies Inversely ) แต่ ผลคูณระหว่างความดันกับปริมาตร (PV) เป็นค่าคงที่ และเมื่อเขียนกราฟแสดงความสัมพันธ์ระหว่างความดัน ( P ) กับปริมาตร ( V ) ของแก๊สจะเป็นดังนี้

สังเกตกราฟแสดงความสัมพันธ์ระหว่างปริมาตรกับความดัน ( V กับ P ) จะไม่เป็นเส้นตรง แต่ถ้าเขียนกราฟแสดงความสัมพันธ์ระหว่าง V กับ หรือ P กับ จะได้กราฟที่เป็นเส้นตรง
การคำนวณสมบัติของแก๊สตามกฏของบอยล์
- ปริมาตรแปรผกผันกับความดัน เขียนว่า
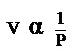
- ผลคูณระหว่างความดันกับปริมาตรเป็นค่าคงที่ เขียนว่า PV = k
เนื่องจากมีการทดลองซ้ำหลาย ๆ ครั้ง จำนวน PV จะมีหลายครั้งด้วย แต่เป็นค่าคงที่ เช่น
P1V1 = k1 ………. (1)
P2V2 = k2 .……….(2)
PnVn = kn ………. (n)
สมการเพื่อการคิดคำนวณด้วยกฎของบอยล์คือ P1V1 = P2V2 … = PnVn = k
เขียนสั้น ๆ ว่า P1V1 = P2V2
* P1 กับ P2 ต้องเป็นหน่วยเดียวกัน
* V1 กับ V2 ต้องเป็นหน่วยเดียวกัน
ตัวอย่างที่ 1 แก๊สชนิดหนึ่งมีมวล 15 กรัม มีปริมาตร 10 dm3 ที่ความดัน 150 mmHg เมื่ออุณหภูมิคงที่ ถ้า
เปลี่ยนความดันเป็น 50 mmHg แก๊สจะมีปริมาตรเท่าใด
วิธีทำ ก่อนอื่นให้คิดเอาไว้ว่าสมบัติของแก๊สตามกฎของบอยล์ เป็นการเปรียบเพื่อหาความสัมพันธ์ระหว่างปริมาตร (V) กับความดัน (P) ของแก๊สที่มีจำนวนโมล (n) และอุณหภูมิ (T) คงที่ ถ้าโจทย์กำหนดข้อมูลมาให้อย่างเพียงพอ ให้ใช้ข้อมูลตามที่โจทย์กำหนด แต่ถ้ามีข้อมูลไม่เพียงพอให้เปรียบเทียบกับภาวะ STP สำหรับตัวอย่างนี้โจทย์ให้ข้อมูลมาครบทั้ง P1 P2 และ V1 แล้วถามค่า V2
P1 = 150 mmHg
P2 = 50 mmHg
V1 = 10 ลิตร
V2 = ?
จากกฎของบอยล์ P1V1 = P2V2
150 x 10 = 50 x V2
= 30 ลิตร
ตัวอย่างที่ 2 ใช้ Mg จำนวน 1.00 โมล ทำปฏิกิริยากับสารละลายกรด HCl ซึ่งมากเกินพอ เกิดปฏิกิริยาดังสมการ : Mg(s) + 2HCl(aq) è MgCl2(aq) + H2(g)
ถ้าทดลองที่อุณหภูมิ 0 oC ความดัน 0.80 atm จะได้ H2 กี่ dm3
วิธีทำ กรณีนี้เมื่อพิจารณาสิ่งที่โจทย์กำหนดมาให้จะมีดังนี้
1. กำหนดจำนวนโมลของ Mg ทำให้หาจำนวนโมลของ H2 ได้
จากสมการ ; จำนวนโมลของ H2 ที่ได้ = จำนวนโมลของ Mg ที่ใช้
จำนวนโมล (n)ของ H2 = 1.00 โมล
2. กำหนดอุณหภูมิ (T) = 0 oC
3. กำหนดความดัน (P) = 0.8 atm
ข้อมูลตามที่โจทย์กำหนดมานี้อุณหภูมิและความดันมีเพียงชนิดละ 1 ค่า แต่อุณหภูมิที่กำหนดคือ 0 oC ซึ่งเป็นอุณหภูมิของภาวะ STP ถ้าพบคำถามทำนองนี้ให้นำภาวะที่โจทย์กำหนดไปเปรียบเทียบกับภาวะ STP หรือในอีกกรณีหนึ่ง กำหนดความดันมาให้ค่าเดียวและ = 1 atm ซึ่งเป็นความดันที่ภาวะ STP เช่นกัน จึงคิดคำนวณได้โดยนำไปเปรียบเทียบกับภาวะ STP
* แต่ถ้ากำหนดอุณหภูมิหรือความดันมาอย่างละค่าเดียว แต่ไม่ใช่ 0 oC ไม่ใช่ 1 atm จะคำนวณโดยใช้กฎของบอยล์ไม่ได้
วิธีคิดเป็นดังนี้
ที่ภาวะ STP (ให้เป็นภาวะที่ 1 )
n = 1 mol
T = 0 oC
P1 = 1 atm
V1 = 22.4 dm3
ที่ภาวะตามโจทย์กำหนด (ให้เป็นภาวะที่ 2)
n = 1 mol
T = 0 oC
P2 = 0.8 atm
V2 = ?
กฎของบอยล์
P1V1 = P2V2
1.00 x 22.4 = 0.80 x V2
= 28.00 dm3 ตอบ
คำถาม V1 = 22.4 dm3 และ V2 = 28.00 dm3 ทั้ง 2 กรณีนี้แก๊สมีจำนวนโมเท่ากันหรือไม่
หมายเหตุ หน่วยความดันบรรยากาศหน่วยอื่น ๆ ที่ควรทราบได้แก่
** ปาสคาล (Pa) 1 ปาสคาลมีค่าเท่ากับ 9.8692×10−6 atm
** 1 atm เท่ากับ 101.325 kPa (กิโลปาสคาล)
** ปอนด์/ตารางนิ้ว (pound per square inch, Psi) ; 14.7 ปอนด์ ต่อตารางนิ้ว = 1 บรรยากาศ
** 1 atm เท่ากับ 1 บาร์
(คลิ้ก ชมการทดลองของบอยล์)
แบบฝึกหัด
1. แก๊สชนิดหนึ่งบรรจุในถังเหล็กที่มีปริมาตร 20 ลิตร มีความดัน x atm ถ้าถ่ายแก๊สจำนวนนี้ไปใส่ถัง
สุญญากาศอีกใบหนึ่งซึ่งมีปริมาตร 5 ลิตรและมีอุณหภูมิเท่าเดิม พบว่ามีความดัน 18 atm จงหาความ
ดันของแก๊สในถังใบเดิม
1. 2 atm 2. 4.5 atm 3. 12 at 4. 25.5 atm
2. แก๊สชนิดหนึ่งมีปริมาตร 500 cm3 ที่ความดัน 1 บรรยากาศ อุณหภูมิ 27 oC เมื่อลดปริมาตรของแก๊สลง
เหลือ 100 cm3 โดยอุณหภูมิและมวลของแก๊สคงที่ วัดความดันได้ 4 บรรยากาศ จงคำนวณหาว่าความ
ดันที่วัดได้มีความคลาดเคลื่อนไปจากความดันที่เป็นไปตามกฎของบอยล์กี่เปอร์เซ็นต์
1. 20 2. 40 3. 60 4. 80
3. At constant temperature, a sample of 3.0 L of Ne gas at 2.0 atm is compress until the pressure is
3.524 atm. What is the new volume? (แก๊สนีออน 3.0 ลิตร มีความดัน 2.0 atm ถูกอัดจนทำให้ความ
ดันเพิ่มขึ้นเป็น 3.524 atm โดยอุณหภูมิคงที่ ปริมาตรของแก๊สเป็นเท่าไร)
4. A fix quantity of gas at a constant temperature exhibits a pressure of 737 torr and
occupied a volume of 20.5 L. Use Boyle’s law ; (แก๊สซึ่งมีปริมาณและอุณหภูมิคงที่ มีความดัน
737 torr มีปริมาตร 20.5 ลิตร จงใช้กฎของบอยล์ )
a. the volume the gas will occupy if the pressure is increases to 1.80 atm. (ถ้าทำให้ความ
ดันเพิ่มขึ้นเป็น 1.80 atm ปริมาตรของแก๊สจะเป็นเท่าไร)
b. the pressure of the gas if the volume is decrease to 16.0 L. (ถ้าเลดปริมาตรเหลือ 16
ลิตร ความดันจะเป็นเท่าไร)
5. Calculate the final pressure of each gas, assuming that the temperature remaining
constant at 25 oC. (จงคำนวณหาความดันของแก๊สแต่ละชนิดต่อไปนี้ ซึ่งมีอุณหภูมิ 25 oC คงที่)
a. 2.02 cm3 of CO at 724 torr expands to 25.00 mL. (แก๊ส CO 2.02 cm3 มีความดัน 724
torr ทำให้ปริมาตรเพิ่มขึ้นเป็น 25.00 mL)
b. 57.66 mL of H2 at 2.00 atm is compress to 5.11 mL. ( แก๊ส H2 57.66 mL มีความดัน 2.00
atm อัดจนปริมาตรลดลงเหลือ 5.11 mL)
c. 1200 L of He at 1.00 atm expands to 5200 L. ( แก๊ส He 1200 L มีความดัน 1.00 atm ขยาย
ปริมาตรเป็น 5200 L.)
6. Calculate the final volume for each of these gases. The temperature remains constant at
25 oC in all cases. (จงคำนวณหาปริมาตรของแก๊สแต่ละชนิดต่อไปนี้ ซึ่งมีอุณหภูมิ 25 oC คงที่)
a. 2.00 x 103 L of NH3 at 1.00 atm in place under under a pressure of 500 torr. (แก๊ส
แอมโมเนีย 2.00 x 103 L มีความดัน 1.00 atm ทำให้ความดันลดลงเหลือ 500 torr)
b. 2.555 atm of pressure is applied to 20.56 mL of H2 at 1.00 atm.(แก๊ส H2 จำนวน 20.56
mL มีความดัน 1.00 atm ถ้ามีความดัน 2.555 atm มีปริมาตรเท่าไร)
c. 50.0 atm of pressure is applied to 7.70 x 103 L of He at 0.977 atm. (แก๊ส He มีปริมาคร
7.70 x 103 L ที่ความดัน 0.977 atm ถ้ามีความดัน 50.0 atm มีปริมาตรเท่าไร )
8. A gas bubble has a volume of 0.650 mL at the bottom of a lake at 81 feet, where the total pressure
is 3.46 atm. What is the volume of the bubble when it reaches the surface of the lake, where the
pressure is 1.00 atm? Assume that the temperature is constant. (ans.e) ; (ฟองก๊าศขณะอยู่ก้น
ทะเลสาบลึก 81 ฟุต มีปริมาตร 0.650 mL ขณะนั้นมีความดัน 3.46 atm เมื่อฟองแก๊สลอยตัวขึ้นมาถึงผิว
น้ำซึ่งมีความดัน 1.00 atm ฟองแก๊สจะมีปริมาตรเท่าไร)
a) 1.20 mL b) 0.188 mL c) 1.90 mL d) 0.122 mL e) 2.25 mL
9. A 6.5 L sample of nitrogen at 25oC and 1.5 atm is allowed to expand to 13.0 L. The temperature remains constant. What is the final pressure (atm)? (ans.e) ; (ที่อุณหภูมิ25oC ความดัน 1.5 atm แก๊สไนโตรเจนจำนวนหนึ่งมีปริมาตร 6.5 L ถ้าเพิ่มปริมาตรขึ้นเป็น 13.0 L โดยอุณหภูมิคงที่ ความดันของแก๊สจะเป็นกี่ atm)
a) 0.380 b) 0.12 c) 3.0 d) 0.063 e) 0.75
10. The volume of one cylinder in an automobile is 0.44 L. The cylinder is filled with a gasoline and air mixture at 1.0 atm and then is compressed to 0.073 L prior to ignition. What pressure must be applied to produce this compression? (ans.d) ; (กระบอกสูบของเครื่องยนต์มีปริมาตร 0.44 L มีไอของน้ำมันแกสโซลีนผสมกับ อากาศบรรจุอยู่มีความดัน 1 atm เมื่อเกิดการอัดจนปริมาตรลดลงเหลือ 0.073 L ความดันจะเป็นเท่าไร)
a) 4.4 atm b) 3.6 atm c) 3.1 atm d) 6.0 atm e) 7.3 atm
11. An adult human breathes 0.50 L of air at 1.0 atm with each breath. If a 50 L air tank at 200 atm is available, how many breaths will the tank provide? (ans.c) ; (ปอดของผู้ใหญ่จุอากาศได้ 0.5 L ที่ความดัน 1 atm ต่อการหายใจ 1 ครั้ง ถ้าหายใจโดยใช้อากาศจากถังขนาด 50 L ความดัน 200 atm จะหายใจได้กี่ครั้ง)
a) 5.0 x 104 b) 4.0 x 104 c) 2.0 x 104 d) 1.0 x 104 e) 5.0 x 103
รูปภาพที่เกี่ยวข้อง

Size : 45.27 KBs
Upload : 2014-02-13 05:27:50
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|