ของแข็ง ของเหลว แก๊ส (ตอนที่ 12) การแพร่ของแก๊ส (Diffusion of gas)
การแพร่ของแก๊ส (Diffusion of gas)
หมายถึงกระบวนการที่โมเลกุลของแก๊สเคลื่อนที่จากบริเวณที่มีความเข้มข้นสูงหรือความหนาแน่นสูง ไปยังบริเวณที่มีความเข้มข้นต่ำกว่าหรือความหนาแน่นต่ำกว่า
(คลิ้ก ชมการแพร่ของแก๊ส) (คลิ้ก ชมการแพร่ของแก๊ส)
Thomas Graham (คลิ้ก อ่านประวัติ ) เป็นผู้ทดลองพบสมบัติในการแพร่ของแก๊สเมื่อ ค.ศ. 1829 (พ.ศ. 2372) พบว่าอัตราเร็วในการแพร่ของแก๊สใด ๆ จะแปรผกผันกับรากที่ 2 ของมวลโมเลกุลของแก๊ส หรือรากที่ 2 ของความหนาแน่นของแก๊สนั้น ๆ เขียนในรูปของสัญลักษณ์ว่า
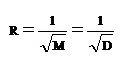
อัตราเร็วในการแพร่ของ He เป็นดังนี้
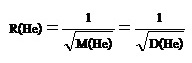
อัตราเร็วในการแพร่ของ CH4 เป็นดังนี้
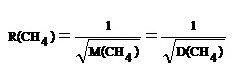
** เปรียบเทียบระหว่างอัตราเร็วในการแพร่ของ He : อัตราเร็วในการแพร่ของ CH4 เป็นดังนี้
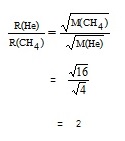
หมายความว่า ที่ภาวะเดียวกัน แก๊ส He จะแพร่เร็วกว่า CH4 อยู่ 2 เท่า หรือในทางกลับกันแก๊ส CH4 จะแพร่ได้ระยะทางเป็นครึ่งหนึ่งของ He และให้ทำความเข้าใจว่าอัตราเร็วในการแพร่ของแก๊สจะแปรผันตรงกับอุณหภูมิ แก๊สทุกชนิดจะมีอัตราเร็วในการแพร่เพิ่มขึ้นเมื่ออุณหภูมิสูงขึ้น การเปรียบเทียบอัตราเร็วในการแพร่ของแก๊สต้องเปรียบเทียบกันที่อุณหภูมิเดียวกัน
โดยทั่วไปแล้วแก๊สที่มีมวลโมเลกุลหรือมวลอะตอมน้อย จะมีอัตราเร็วในการแพร่มากกว่ากว่าแก๊สที่มีมวลอะตอมหรือมวลโมเลกุลมาก สมบัติดังกล่าวนี้อธิบายได้ด้วยทฤษฎีจลน์ของแก๊สข้อ 4 ที่กล่าวว่าในสภาวะหนึ่ง ๆ โมเลกุลของแก๊สแต่ละโมเลกุลจะมีอัตราเร็วในการเคลื่อนที่และพลังงานจลน์แตกต่างกันเป็นช่วงกว้าง แต่เมื่อคิดเป็นพลังงานจลน์เฉลี่ยแล้วจะเท่ากัน คือ
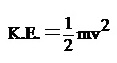
เมื่อ v = อัตราเร็วในการเคลื่อนที่ของโมเลกุล
m = มวลโมเลกุลของแก๊ส
การแพร่ของแก๊สจะเร็วหรือช้าจะอยู่ที่อัตราเร็วในการเคลื่อนที่ของโมเลกุล ถ้าโมเลกุลมีอัตราเร็วในการเคลื่อนที่ ( V )สูงอัตราเร็วในการแพร่ ( R ) ของแก๊สก็จะมาก เมื่อคำนวณหาอัตราเร็วในการเคลื่อนที่ของโมเลกุลของแก๊สจะพบว่า แก๊สที่มีมวลโมเลกุลมากจะมีอัตราเร็วในการเคลื่อนที่ของโมเลกุลน้อย เช่น ระหว่าง He กับ CH4 จะเป็นดังนี้

จะเห็นได้ว่าอัตราเร็วในการเคลื่อนที่ของ He เป็น 2 เท่าของ CH4 ฉะนั้นเมื่อแก๊สทั้ง 2 ชนิดนี้อยู่ที่อุณหภูมิเดียวกัน แก๊ส He จะมีอัตราเร็วในการแพร่เป็น 2 เท่า
ของ CH4 เสมอ โดยเมื่ออุณหภูมิสูงขึ้นอัตราเร็วในการแพร่จะเพิ่มขึ้น แต่ He จะแพร่ได้เป็น 2 เท่าของ CH4 อย่างเดิม
การคิดอัตราเร็วในการแพร่ของแก๊ส ไม่จำเป็นต้องคิดจากระยะทางที่แก๊สแพร่ไปได้เพียงอย่างเดียว คิดจากจำนวนโมลหรือมวลของแก๊สก็ได้ เช่น แก๊ส He และ CH4 เมื่อเก็บไว้ในถัง
แล้วมีรูรั่ว แก๊สที่รั่วออกไปก็เกิดจากการแพร่เช่นกัน ถ้าอยู่ที่อุณหภูมิเดียวกันและรูรั่วมีขนาดเท่ากัน จำนวนโมลของแก๊ส He ที่รั่วออกไปก็จะเป็น 2 เท่าของจำนวนโมลของ CH4 ด้วยเช่นกัน
แบบฝึกหัด
1. A mixture of 0.50 mole H2 and 0.50 mole of SO2 is introduced into a 10.0 L container at 25oC. The
container has pinhole leak. After a period of time: (Atomic weights: H = 1.008, S = 32.06, O = 1
6.00). (ans.a) (แก๊สผสมประกอบด้วย H20.50 mole และ SO20.50 mole อยู่ในภาชนะที่มีปริมาตร 10.0
ลิตร อุณหภูมิ 25 oC แต่ภาชนะมีรูรั่ว อยากทราบว่าเมื่อเวลาผ่านไปจะเกิดผลดังข้อใด)
a) the partial pressure of SO2 exceeds that of H2 in the remaining gas (แก๊สที่เหลือจะมีความดัน
ย่อยของ SO2 มากกว่าของ H2 )
b) the partial pressure of H2 exceeds that of SO2 in the remaining gas (แก๊สที่เหลือจะมีความดัน
ย่อยของ H2 มากกว่าของ SO2 )
c) the partial pressures of the two gases remain equal throughout this time (ความดันย่อยของแก๊ส
ทั้งสองจะคงที่ตลอดเวลา)
2. In an effusion apparatus, H2 is found to effuse at the rate of 5.9 mL/s. Another gas in the same
apparatus effuses at the rate of 0.55 mL/s. What is the molecular weight of the gas? (Atomic
weight: H = 1.008). (ans.a) (ในภาวะหนึ่งพบว่าอัตราเร็วในการแพร่ของ H2 = 5.9 mL/s ขณะที่แก๊สอีก
ชนิดหนึ่งมีอัตราเร็วในการแพร่ 0.55 mL/s อยากทราบว่าแก๊สชนิดนี้มีมวลโมเลกุลเท่าไร)
a) 230 b) 52 c) 132 d) 430 e) 21
3. Two identical balloons are filled, one with helium and one with nitrogen at the same temperature. If
the nitrogen balloon leaks at the rate of 75 mL per hour, what will be the rate of leakage from the
helium balloon? (Atomic weights: He = 4.00, N = 14.01). (ans.a) (บัลลูน 2 ใบ ใบหนึ่งบรรจุด้วยแก๊ส
He อีกใบหนึ่งบรรจุด้วยแก๊ส N2 ที่อุณหภูมิเดียวกัน ถ้าพบว่าอัตราเร็วในการรั่วไหลของแก๊ส N2 เท่ากับ 75
mL ต่อชั่วโมง อยากทราบว่าอัตราเร็วในการรั่วไหลของฮีเลียมเป็นดังข้อใด)
a) 198 mL/hr b) 75 mL/hr c) 122 mL/hr d) 14 mL/hr e) 28 mL/hr
4. A mixture of 0.50 mole N2 and 0.50 mole of CO2 is introduced into a 10.0 L container at 25oC. The
container has pinhole leak. After a period of time: (Atomic weights: N = 14.01, C = 12.01, O =
16.00). (ans.a) (แก๊สผสมซึ่งประกอบด้วย N20.50 mole และ CO2 0.50 mole บรรจุในภาชนะขนาด 10.0
ลิตร อุณหภูมิ 25 oC ปรากฏว่าภาชนะเกิดรูรั่ว อยากทราบว่าเมื่อเวลาผ่านไปจะเกิดผลดังข้อใด)
a) the partial pressure of CO2 exceeds that of N2 in the remaining gas (แก๊สที่เหลือจะมีความดันย่อย
ของ CO2 มากกว่าของ N2)
b) the partial pressures of the two gases remain equal throughout this time (ความดันย่อยของแก๊สทั้ง
2 ชนิดจะคงที่ตลอดเวลา)
c) the partial pressure of N2 exceeds that of CO2 in the remaining gas (แก๊สที่เหลือจะมีความดันย่อย
ของ N2 มากกว่าของ CO2)
5. Calculate the relative rate of diffusion of HF compared to HCl. (Atomic weights: H = 1.008,
Cl = 35.45, F = 19.00). (ans.a) (อัตราเร็วในการแพร่ของ HF : HCl เป็นดังข้อใด)
a) 1.35 b) 0.741 c) 1.21 d) 0.549 e) 1.82
6. Two identical porous containers are filled, one with hydrogen and the other with carbon dioxide. If
under the same conditions, 1.50 mL of carbon dioxide leaks from the container in one day, how
much hydrogen will leak out? (Atomic weights: H = 1.008, C = 12.01, O = 16.00). (ans.a) (ภาชนะ
ที่มีรูพรุน 2 ใบซึ่งเหมืนกัน ใบหนึ่งบรรจุแก๊สไฮโดรเจน อีกใบหนึ่งบรรจุแก๊สคาร์บอนไดออกไซด์ ปรากฏว่า
คาร์บอนไดออกไซด์สามารถรั่วออกมาได้วันละ 1.50 mL อยากทราบว่าแก๊สไฮโดรเจนจะรั่วได้วันละกี่ mL)
a) 7.04 mL b) 3.40 mL c) 33 mL d) 26 mL e) 2.12 mL
7. (Ent.42 มี.ค.) ของเหลวใดมีค่าความร้อนแฝงของการกลายเป็นไอสูงสุด และเมื่อเปลี่ยนสถานะเป็นแก๊สสารใดจะมีอัตราการแพร่สูงสุดในเวลาเดียวกัน
|
ของเหลว
|
มวลโมเลกุล
|
จุดเดือด(oC)
|
|
A
|
78.1
|
80.1
|
|
B
|
142.6
|
197.5
|
|
C
|
168.4
|
222.0
|
|
D
|
215.5
|
174.0
|
|
|
ความร้อนแฝงของการกลายเป็นไอสูงสุด
|
อัตราการแพร่สูงสุด
|
|
1.
|
A
|
A
|
|
2.
|
C
|
B
|
|
3.
|
D
|
A
|
|
4.
|
C
|
A
|
8. (Ent.43 มี.ค.)
|
แก๊สสมบูรณ์
|
น้ำหนัก (g)
|
P(atm)
|
V (dm3)
|
T (oC)
|
|
ก
|
2.73
|
0.51
|
3.0
|
27
|
|
ข
|
0.14
|
0.112
|
1.0
|
0
|
|
ค
|
2.73
|
0.70
|
3.2
|
47
|
จากข้อมูลในตาราง การเรียงลำดับอัตราเร็วในการแพร่ของแก๊สทั้ง 3 ชนิดจากมากไปน้อยเป็นดังข้อใด
1. ก ข ค 2. ข ก ค 3. ค ก ข 4. ข ค
9. (Ent.44 มี.ค.) ในการศึกษาสมบัติของแก๊ส 3 ชนิด ได้ผลการทดลองดังนี้
|
ชนิดของแก๊ส
|
น้ำหนัก (g)
|
ปริมาตร (cm3)
|
อุณหภูมิ (oC)
|
ความดัน (atm)
|
|
A
|
0.16
|
0.20
|
100
|
0.50
|
|
B
|
22
|
20.0
|
T1
|
P1
|
|
C
|
56
|
80.0
|
T1
|
P1
|
ข้อสรุปใดผิด
1. แก๊ส A มีมวลโมเลกุลเท่ากับ 49
2. แก๊ส C แพร่ได้เร็วกว่าแก๊ส B
3. แก๊ส B คือ CO2 และแก๊ส C คือ CO
4. ถ้า P1 เท่ากับ 0.41 atm และ T1 เท่ากับ -73 oC แก๊ส A มีมวลโมเลกุลน้อยกว่าแก๊ส C
10. (Ent.46 ต.ค.) เมื่อบรรจุแก๊ส 3 ชนิด คือ แอมโมเนีย ออกซิเจน และคาร์บอนไดออกไซด์ ในลูกโป่ง 3 ใบ ใบละชนิด โดยควบคุมให้ลูกโป่งมีปริมาตรเท่ากัน แล้วปล่อยลูกโป่งทั้ง 3 ใบ
ไว้ค้างคืนในห้องที่ควบคุมอุณหภูมิและความดันให้คงที่ วันรุ่งขึ้นพบว่าลูกโป่งทุกใบมีขนาดเล็กลง ลูกโป่งที่บรรจุแก๊สแอมโมเนียมีขนาดเล็กที่สุด ส่วนลูกโป่งที่บรรจุแก๊สคาร์บอนไดออกไซด์มีขนาดใหญ่
ที่สุด พิจารณาข้อสรุปต่อไปนี้
ก. มีการแพร่ของแก๊สเกิดขึ้น
ข. อัตราการแพร่ของแก๊สเป็นดังนี้ NH3>O2>CO2
ค. คาร์บอนไดออกไซด์มีมวลโมเลกุลมากจึงแพร่ได้ช้า
ง. แอมโมเนียสร้างพันธะไฮโดรเจนระหว่างโมเลกุล ปริมาตรของแก๊สจึงลดลง
ข้อสรุปใดถูก
1. ก ข 2. ค ง 3. ก ข ค 4. ก ค ง
11. (Ent.47 มี..ค.) ที่อุณหภูมิคงที่ ภาชนะใบหนึ่งมีขนาดเท่ากับ V ลิตร ถูกแบ่งออกเป็น 2 ส่วนเท่า ๆ กัน (A และ B) โดยมีผนังกั้น ถ้าภาชนะส่วน A บรรจุแก๊ส X และแก๊ส Y
ที่มีมวลโมเลกุล M และ 16M ตามลำดับ อย่างละ 10 โมล ในขณะที่ภาชนะส่วน B เป็นสูญญากาศ หากมีรูรั่วเล็ก ๆ ที่ผนังกั้นทำให้แก๊งทั้งสองแพร่ไปยังภาชนะส่วน B โดยแก๊ส Y
แพร่ด้วยอัตราเร็ว 1 โมลต่อนาที ทั้งไว้จนระบบเข้าสู่ภาวะสมดุล พิจารณาข้อสรุปต่อไปนี้
ก. ภาชนะส่วน A มีแก๊ส X 5 โมล และแก๊ส Y 5 โมล
ข. ภาชนะส่วน A มีแก๊ส X 2 โมล และแก๊ส Y 8 โมล
ค. พลังงานจลน์ของแก๊ส X สูงกว่าพลังงานจลน์ของแก๊ส Y
ง. ความดันสุดท้ายของภาชนะ A เท่ากับครึ่งหนึ่งของความดันเริ่มต้น
ข้อใดถูก
1. ก ค 2. ก ง 3. ข ค 4. ข ง
12. (เคมีโอลิมปิครอบคัดเลือก 45) ข้อความใดต่อไปนี้กล่าวถึงสมมติฐานสำหรับทฤษฎีจลน์ของแก๊สสมบูรณ์
ได้อย่างถูกต้อง
1. ที่อุณหภูมิเดียวกันแก๊สแต่ละชนิดมีพลังงานจลน์เฉลี่ยไม่เท่ากัน ทั้งนี้ขึ้นกับมวลโมเลกุลของแก๊ส
2. โมเลกุลของแก๊สมีมวลน้อยมากจนถือได้ว่าเป็นศูนย์
3. โมเลกุลของแก๊สจะอยู่ห่างกันมากและไม่มีแรงกระทำต่อกัน
4. โมเลกุลของแก๊สเคลื่อนที่อย่างอิสระตลอดเวลาด้วยอัตราเร่งคงที่ในแนวเส้นตรง
13. (เคมีโอลิมปิครอบคัดเลือก 45) แก๊ส He มักพบว่ารวมอยู่กับแก๊ส CH4 เมื่อเปรียบเทียบอัตราการแพร่
ของแก๊สทั้ง 2 ชนิดที่อุณหภูมิเดียวกัน He จะมีอัตราการแพร่ดังข้อใด
1. เร็วกว่า CH4 อยู่ 16 เท่า 2. เร็วกว่า CH4 อยู่ 4 เท่า
3. เร็วกว่า CH4 อยู่ 2 เท่า 4. เท่ากับ CH4
14. Pat 2 (ก.ค. 52) การเรียงลำดับอัตราการแพร่ของแก๊ส ที่อุณหภูมิ 25 oC ความดัน 1.0 บรรยากาศ ข้อ
ใดถูกต้อง
1. NH3 > CO > CO2 2. SO3 > N2O3 > C4H10
3. CO2 > NO2 > SO2 4. ข้อ 1 และข้อ 3
15. แก๊สใดมีอัตราเร็วในการแพร่เป็น 4 เท่าของ SO2
1. H2 2. O2 3. CH4 4. He
16. แก๊ส X2 มีอัตราเร็วในการแพร่เป็น 1.414 เท่า ของแก๊ส C3H4 จงหาว่าแก๊ส X2 มีความหนาแน่นเป็นกี่
เท่าของแก๊ส He ที่อุณหภูมิและความดันเดียวกัน
1. 2 2. 4 3. 5 4. 7
17. แก๊ส A มีอัตราเร็วในการแพร่เป็น 2 เท่า ของแก๊สซัลเฟอร์ไดออกไซด์ จงคำนวณว่าแก๊ส A มีความ
หนาแน่นเป็นกี่เท่าของแก๊สโอโซนที่อุณหภูมิและความดันเดียวกัน
1. 0.33 2. 1.21 3. 2.53 4. 3
18. แก๊ส X มีมวล 0.32 กรัม มีปริมาตร 1 ลิตร ที่อุณหภูมิ -73 oC ความดัน 0.082 บรรยากาศ จงหาว่า
แก๊ส X มีอัตราเร็วในการแพร่เป็นกี่เท่าของ CH4 ที่อุณหภูมิและความดันเดียวกัน
1. 1 2. 2 3. 0.5 4. 0.25
19. แก๊ส O2 แพร่ได้ระยะทาง 2 เมตร ในเวลา 40 วินาที จงคำนวณหาว่าแก๊ส SO2 แพร่ได้ระยะทาง 60
เซ็นติเมตรจะต้องใช้เวลากี่วินาที
1. 12 2. 17 3. 120 4. 170
เพิ่มเติม
1. Small amounts of hydrogen can be produced in the laboratory by reacting zinc with HCl. How
many grams of zinc are required to prepare 2.50 L of hydrogen gas at 765 mm Hg and 22oC?
(Atomic weights: Zn = 65.37, H = 1.008, Cl = 35.45). (ans.d) (การเตรียมแก๊สไฮโดรเจนจำนวนน้อย ๆ
ในห้องทดลอง ใช้ปฏิกิริยาระหว่าง Zn กับ HCl ดังสมการ ถ้าต้องการแก๊สไฮโดรเจน 2.5 ลิตร ที่อุณหภูมิ 22
oC ความดัน 765 mmHg ต้องใช้สังกะสีกี่กรัม)
Zn(s) + 2 HCl(aq) → ZnCl2(aq) + H2(g)
a) 3.40 b) 1.90 c) 8.60 d) 6.80 e) 13.6
2. Calculate the volume (mL) of NH3 at 20oC and 745 mm Hg that can be prepared by the addition of
water to 1.398 g of Mg3N2. (Atomic weights: Mg = 24.30, N = 14.01, H = 1.008, O = 16.00).
(ans.d) (น้ำทำปฏิกิริยากับMg3N2 จำนวน 1.398 กรัม ที่ 20oC ความดัน 745 mm Hg จะได้แก๊ส NH3 กี่
mL) Mg3N2(s) + 6 H2O(l) → 3 Mg(OH)2(s) + 2 NH3(g)
a) 452 b) 342 c) 736 d) 679 e) 548
3. Octane burns according to the following equation. A cylinder in an automobile engine has a
volume of 494 mL. If the cylinder is filled with air (21% O2) at 50oC and 1.00 atm, what mass (g) of
octane must be injected to react with the oxygen? (Atomic weights: C = 12.01, H = 1.008, H =
16.00). (ans.d) (การเผาไหม้ของออกเทนดังสมการ เกิดขึ้นในกระบอกสูบของเครื่องยนต์ ซึ่งมีปริมาตร
494 mL ถ้าในกระบอกสูบมีอากาศซึ่งประกอบด้วย O2 21% อุณหภูมิ 50oC ความดัน 1.00 atm จะต้อง
ใช้ออกเทนกี่กรัมสำหรับเผาไหม้กับออกซิเจนจำนวนนี้)
2 C8H18(l) + 25 O2(g) → 16 CO2(g) + 18 H2O(g)
a) 0.171 b) 0.203 c) 0.0427 d) 0.0358 e) 0.0724
4. A 1.545 g sample of impure calcium carbide reacts with water to give 561 mL of C2H2 collected
by water displacement at 20oC and 745 mm Hg. The vapor pressure of water is 17.5 mm Hg. What
is the % CaC2? (Atomic weights: Ca = 40.08, H = 1.008, C = 12.01, O = 16.00). (ans.c) (แคลเซี่ยน
คาร์ไบน์เนตไม่บริสุทธิ์ จำนวน 1.545 g ทำปฏิกิริยากับน้ำ มี C2H2 เกิดขึ้น 561 mL อุณหภูมิ 20 oC
ความดัน 745 mmHg ถ้าความดันไอของน้ำเท่ากับ 17.5 mmHg ร้อยละของแคลเซียมคาร์ไบน์เป็นเท่าไร)
CaC2(s) + 2 H2O(l) → Ca(OH)2(s) + C2H2(g)
a) 87.2 b) 90.2 c) 92.7 d) 94.2 e) 95.1
5. A mixture contains 50% aluminum and 50% tin. What volume of H2 at 740 mm Hg and 20oC will be
collected by displacement of water by reacting 1.00 g of the mixture with HCl? The vapor pressure
of water is 17.5 mm Hg. (Atomic weights: Al = 26.98, Sn = 118.7, H = 1.008, O = 16.00, Cl =
35.45). (ans.c) (ของผสมประกอบด้วย Al และ Sn ชนิดละ 50 % ถ้านำของผสมนี้มา 1.00 กรัม ทำ
ปฏิกิริยากับกรด HCl แล้วเก็บแก๊ส H2 โดยการแทนที่น้ำ ปริมาตรของแก๊ส H2 ที่ได้เป็นเท่าไร ที่ความดัน
740 mmHg อุณหภูมิ 20 oC ถ้าความดันไอของน้ำเท่ากับ 17.5 mmHg)
2 Al(s) + 6 HCl(aq) 3 H2(g) + 2 CrCl3(aq)
Sn(s) + 2 HCl(aq) → H2(g) + SnCl2(aq)
a) 750 b) 710 c) 809 d) 790 e) 830
6. A 3.00 g sample of a mixture contains copper and zinc. Zinc reacts with HCl but copper does not.
What is the % Zn if 927 mL of hydrogen gas is collected by displacement of water at 740 mm Hg
and 20oC. The vapor pressure of water is 17.5 mm Hg. (Atomic weights: Zn = 65.39, H = 1.008, Cl
= 35.45, O = 16.00). (ans.c) (โลหะผสมระหว่าง Cu กับ Zn หนัก 3.00 กรัม เมื่อนำไปทำปฏิกิริยากับ
สารละลายกรด HCl ปรากฏว่า Zn เท่านั้นที่ทำปฏิกิริยา แต่ Cu ไม่ทำปฏิกิริยา พบว่ามีแก๊ส H2 เกิดขึ้น
927 mL ซึ่งเก็บได้ด้วยการแทนที่น้ำ ที่อุณหภูมิ 20 oC ความดัน 740 mmHg โดยความดันไอของไอน้ำ
เท่ากับ 17.5 mm Hg ร้อยละของ Zn ในโลหะผสมเป็นเท่าไร)
Zn(s) + 2 HCl(aq) → ZnCl2(aq) + H2(g)
a) 82.8 b) 81.7 c) 79.8 d) 85.3 e) 77.1
7. Which of the following statements about kinetic energy (K.E.) is true? (ans.d) (การกล่าวถึงทฤษฎี
จลน์ของก๊าซในข้อใดถูกต้อง)
a) none of the above statements is true (ไม่มีข้อใดถูก)
b) All objects moving with the same velocity have the same K.E. (ทุกอนุภาคเคลื่อนที่เร็วเท่ากันและมี
พลังงานจลน์เท่ากัน)
c) As the velocity of a body increases, its K.E. decreases. (ถ้าอนุภาคมีความเร็วเพิ่มขึ้นพลังงานจลน์
จะลดลง)
d) The K.E. of a body will quadruple if its velocity doubles. (พลังงานจลน์จะเพิ่ม 4 เท่า เมื่อความเร็ว
เพิ่ม 2 เท่า)
e) The K.E. of a body is independent of its mass. (พลังงานจลน์ของอนุภาคขึ้นอยู่กับมวลของอนุภาค)
8. The Ne atom has 10 times the mass of H2. Which of the following statements is true? (ans.d)
(อะตอมของ Ne มีมวลเป็น 10 เท่าของ H2 จงพิจารณาว่าคำกล่าวในข้อใดถูกต้อง)
I. At 25oC they both have the same kinetic energy. (ที่อุณหภูมิ 25 oC อนุภาคทั้งสองมีพลังงานจลน์เท่ากัน)
II. Ten moles of H2 would have the same volume as 1 mole of Ne. ( H2 จำนวน 10 โมล มีปริมาตรเท่ากับ Ne จำนวน 1 โมล)
III. One mole of Ne exerts the same pressure as one mole of H2 at STP. ( Ne 1 โมล มีความดันเท่ากับ H2 1 โมล ที่ STP )
IV. A H2 molecule travels 10 times faster than an Ne atom. (โมลเลกุลของ H2 เคลื่อนที่เร็วกว่าอะตอมของ Ne 10 เท่า)
V. At STP, one liter of Ne has 10 times the density of 1 liter of H2. (ที่ STP Ne 1 ลิตร มีความหนาแน่นเป็น 10 เท่าของ H2 1 ลิตร)
a) I, III, IV, V b) II, IV, V c) I, II, III d) I, III, V e) I, II
9. Which of the following is not an assumption of the kinetic molecular theory for D gas? (ans.d)
(สมบัติของก๊าซ D ในข้อใดไม่ถูกต้องตามทฤษฎีจลน์ของก๊าซ)
a) All of the above are correct. (ถูกทุกข้อ)
b) Gases are made up of tiny particles in constant chaotic motion. (อนุภาคของก๊าซมีขนาดเล็ก
มากเคลื่อนที่อยู่ตลอดเวลาอย่างไม่เป็นระเบียบ)
c) Gas particles are very small compared to the average distance between the particles. (อนุภาค
ของก๊าซมีขนาดเล็กมากเมื่อเปรียบเทียบกับระยะห่างระกว่างโมเลกุลของก๊าซ)
d) The average velocity of the gas particles is directly proportional to the absolute temperature.
(อัตราเร็วเฉลี่ยนของโมเลกุลของก๊าซเป็นสัดส่วนโดยตรงกับอุณหภูมิสมบูรณ์)
e) Gas particles collide with the walls of their container in elastic collisions. (การชนระหว่าง
อนุภาคของก๊าซกับผนังของภาชนะที่บรรจุก๊าซเป็นการชนแบบยืดหยุ่น)
เพิ่มเติม
1. ที่อุณหภูมิและความดันคงที่ สมบัติของแก๊ส A2 และ B ข้อใดผิด (A=14 B=4)
1. ในเวลาเท่ากัน A2 จะแพร่ได้ระยะทางมากกว่า B
2. อัตราเร็วเฉลี่ยของโมเลกุลของแก๊ส B เป็น 7 เท่าของแก๊ส A2
3. ถ้าแก๊ส A2 และ B มีปริมาตรเท่ากัน จะมีมวลเท่ากันด้วย
1. 1 และ 2 2. 1 และ 3 3. 2 และ 3 4. 1 2 และ 3
2. แก๊ส X หนัก 16 กรัม มีปริมาตร 15.5 dm3 ที่ 105 oC ความดัน 760 mmHg จงหาว่าที่อุณหภูมิ
เดียวกัน แก๊ส X จะมีอัตราเร็วเฉลี่ยของโมเลกุลเป็นกี่เท่าของแก๊ส SO2
1. 2 2. 3. 0.5 4.
3. บรรจุแก๊สในภาชนะ 2 ใบ ที่มีปริมาตรเท่ากัน ถ้าอุณหภูมิของแก๊สภาชนะที่ 1 สูงกว่าภาชนะที่ 2 แล้ว
ปรากฏว่าความดันของแก๊สในภาชนะทั้ง 2 เท่ากัน จงพิจารณาว่าข้อสรุปใดถูกต้อง
1. ภาชนะใบที่ 1 มีจำนวนโมเลกุลของแก๊สน้อยกว่าภาชนะใบที่ 2
2. มวลโมเลกุลของแก๊สในภาชนะใบที่ 1 น้อยกว่าของแก๊สในภาชนะใบที่ 2
3. โมเลกุลของแก๊สในภาชนะใบที่ 1 มีอัตราเร็วเฉลี่ยสูงกว่าในภาชนะใบที่ 2
&nbs
รูปภาพที่เกี่ยวข้อง

Size : 2.71 KBs
Upload : 2014-02-14 05:26:09
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|



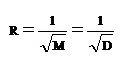
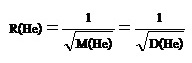
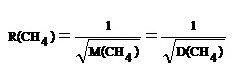
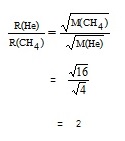
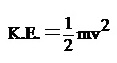

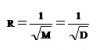
 คะแนนโหวด
คะแนนโหวด

