พันธะเคมี ตอนที่ 2 โครงสร้างของสารไอออนิกและพลังงานกับการเกิดสารไอออนิก
โครงสร้างของสารไอออนิก
สารไอออนิกเกิดจากไอออนบวกและไอออนลบรวมตัวกันอย่างต่อเนื่องสลับกันไปทั้งสามมิติ โดยไม่มีที่สิ้นสุด จึงไม่มีโลเลกุลที่แท้จริงแต่มีลักษณะเป็นผลึก ไม่ใช่โมเลกุล
ขนาดของผลึกจะใหญ่หรือเล็กขึ้นอยู่กับจำนวนไอออนที่รวมตัวกัน สารไอออนิกแต่ละชนิดอาจมีตำแหน่งของไอออนอยู่ไม่ตรงกัน จึงทำให้มีรูปผลึกได้หลายแบบ ในการเขียนสูตรของสารไอออนิกจึงเป็นเพียงสูตรที่แสดงอัตราส่วนอย่างต่ำ ที่ไอออนบวกกับไอออนลบรวมตัวกันเพื่อทำให้ประจุไฟฟ้าหักล้างกันหมดไป จึงไม่เรียกว่าสูตรโมเลกุลแต่เรียกว่าสูตรเอ็มพิริกัลหรือสูตรอย่างง่าย (empirical
formula) ในลักษณะนามที่ใช้เรียกวารไอออนิกใช้คำว่า “หน่วยสูตร”
(formula unit) ไม่ใช่คำว่าโมเลกุล
ในโครงสร้างของผลึกจะพบว่า ไอออนบวกก็จะถูกล้อมรอบด้วยไอออนลบ ขณะเดียวกันไอออนลบก็ถูกไอออนบวกล้อมรอบอยู่เช่นกัน ให้ดูว่าจำนวนไอออนที่ล้อมซึ่งกันและกันมีจำนวนเท่าไร ทำให้เป็นอัตราส่วนอย่างต่ำ แล้วเขียนเป็นสูตรของสารไอออนิก เช่น
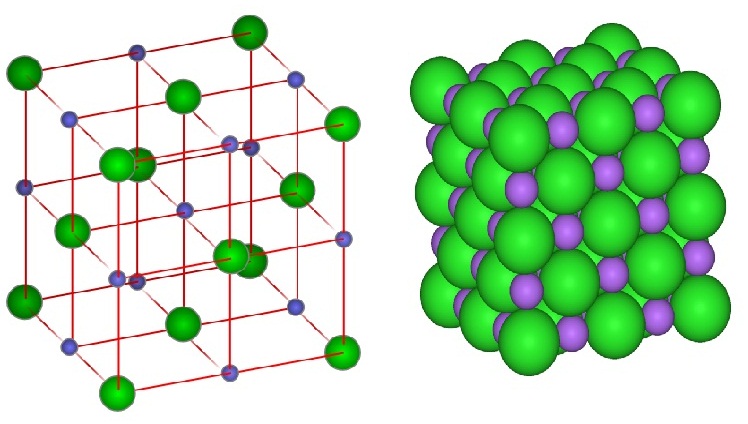
ในผลึกของ
NaCl พบว่า Na+ ถูกล้อมรอบด้วย
Cl- จำนวน 6 ไอออน ขณะเดียวกัน Cl- ก็ถูกล้อมรอบด้วย Na+ จำนวน
6 ไอออนเช่นกัน อัตราส่วนระหว่าง Na+ : Cl- =
6:6 อัตราส่วนอย่างต่ำคือ 1:1 จึงเขียนสูตรของสารประกอบนี้ว่า NaCl ดังรูป (ทรงกลมเล็ก = Na+ ทรงกลม.ใหญ่ = Cl- )
(คลิ้ก ชมการเกิด NaCl และโครงสร้างของผลึก
NaCl)
(คลิ้ก ชมการเกิด NaF และโครงสร้างของผลึก
NaF)
สำหรับผลึกของ CaF2 พบว่า
Ca2+ ถูกล้อมรอบด้วย F- จำนวน
8 ไอออน ในขณะที่ F-
ถูกล้อมรอบด้วย Ca2+ จำนวน
4 ไอออน ทำให้อัตราส่วนระหว่าง Ca2+
: F- =
4:8 อัตราส่วนอย่างต่ำคือ 1:2 จึงเขียนสูตรของสารประกอบนี้ว่า CaF2 ดังรูป (ทรงกลมเล็ก = Ca2+ ทรงกลมใหญ่ = F- )

ในผลึกของ CsCl พบว่า Cs+
ถูกล้อมรอบด้วย Cl-
จำนวน 8 ไอออน ขณะเดียวกัน Cl- ก็ถูกล้อมรอบด้วย Cs+ จำนวน 8 ไอออนเช่นอัน ทำให้อัตราส่วนระหว่าง Cs+ : Cl-
= 8:8 อัตราส่วนอย่างต่ำคือ 1:1 จึงเขียนสูตรของสารประกอบนี้ว่า CsCl ดังรูป (ทรงกลมเล็กคือ Cs+ ทรงกลมใหญ่คือ Cl- )

(คลิ้ก ชมโครงสร้างของผลึกCsCl2)
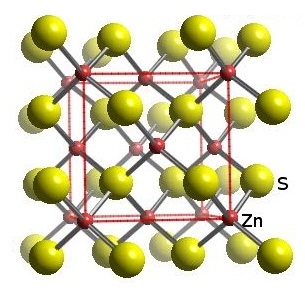
ในผลึกของ
ZnS พบว่า Zn2+ ถูกล้อมรอบด้วย
S2- จำนวน 4 ไอออน ขณะเดียวกัน S2- ก็ถูกล้อมรอบด้วย Zn2+ จำนวน
4 ไอออนเช่นอัน ทำให้อัตราส่วนระหว่าง Zn2+ : S2- =
4:4 อัตราส่วนอย่างต่ำคือ
1:1 จึงเขียนสูตรของสารประกอบนี้ว่า ZnS
ดังรูป (ทรงกลมเล็ก =
Zn2+ ทรงกลมใหญ่
= S2- )
พลังงานกับการเกิดสารประกอบไอออนิก
ในการเกิดปฏิกิริยาต่าง ๆ
จะต้องมีพลังงานเข้ามาเกี่ยวข้องอยู่เสมอ โดยอาจอยู่ในรูปของพลังงานความร้อน (Heat) จึงใช้ ΔH
หรือ H เป็นสัญลักษณ์แทนปริมาณของความร้อนที่เปลี่ยนแปลงไป
(มีสัญลักษณ์อื่น ๆ ด้วย) โดยอาจเป็นการดูดเข้าไปหรือคายออกมาก็ได้ ถ้าปฏิกิริยามีหลายขั้นตอนให้ใช้ตัวเลขเขียนต่อท้ายไว้ เช่น ΔH1 ΔH2 ΔH3 หรือ H1 H2
H3 … และใช้เครื่องหมายบวก (+) สำหรับพลังงานที่ระบบดูดเข้าไป เช่น พลังงานไอออไนเซชัน (IE) ในทางกลับกันใช้เครื่องหมายลบ (-) สำหรับพลังงานที่ระบบคายออกมา เช่น พลังงานอิเล็กตรอนอัฟฟินิตี (EA)
***เครื่องหมายบวกหรือลบเป็นเพียงสัญลักษณ์เพื่อบอกให้ทราบว่าเป็นพลังงานที่ดูดหรือคาย เมื่อใชเครื่องหมายลบ (-) ไม่ได้หมายความว่าพลังงานดังกล่าวมีค่าน้อยกว่าศูนย์
พลังงานที่มีค่าเป็นบวกมีได้หลายขั้นตอน เช่น พลังงานที่ใช้ในการหลอมเหลวหรือความร้อนแฝงของการหลอมเหลว ความร้อนแฝงของการกลายเป็นไอ พลังงานไอออไนเซชัน พลังงานที่ใช้สลายพันธะในโมเลกุลของสารโคเวเลนต์
(มีค่าเท่ากับพลังงานที่คายออกมาเมื่อสร้างพันธะโคเวเลนต์ชนิดนั้น) หรือพลังงานที่ใช้ในการแยกสลายไอออนออกจากผลึกของสารไอออนิก (มีค่าเท่ากับพลังงานที่คายออกมาเมื่อเกิดผลึกของสารไอออนิกนั้น ซึ่งก็คือพลังงานโครงร่างผลึก บางครั้งจึงเรียกสั้น ๆ ว่าพลังงานโครงร่างผลึก)
พลังงานที่มีค่าเป็นลบมีได้หลายขั้นตอนเช่นกัน เช่น สัมพรรคภาพอิเล็กตรอน (อิเล็กตรอนอัฟฟินิตี
,EA) พลังงานโครงร่างผลึก (พลังงานที่คายออกมาเมื่อไอออนบวกกับไอออนลบรวมตัวกันเป็นผลึกของสารไอออนิก) พลังงานไฮเดรชัน จะกล่าวถึงพลังงานแต่ละชนิดโดยย่อดังนี้
1. ความร้อนแฝงของการหลอมเหลว (latent heat of
fusion) คือความร้อนที่ทำให้ของแข็งหลอมเหลวโดยอุณหภูมิคงที่ เป็นค่าเฉพาะตัวของสารแต่ละชนิด ดังตาราง
|
ชนิดของโลหะ
|
Latent Heat of Fusion(cal/g)
|
ชนิดของโลหะ
|
Latent Heat of Fusion(cal/g)
|
|
Aluminum
|
95
|
Iron
|
65
|
|
Beryllium
|
324
|
Lead
|
5.5
|
|
Chromium
|
79
|
Mercury
|
2.7
|
|
Copper
|
49
|
Nickel
|
71
|
|
Gold
|
15
|
Platinum
|
24
|
|
Silver
|
26.5
|
Potassium
|
14.5
|
ความร้อนแผฝงของการหลอมเหลวที่ต่างกันนี้ เป็นค่าที่จะบอกได้ว่าของแข็งแต่ละชนิดหลอมเหลวง่ายหรือยาก ของแข็งที่มีค่าความร้อนแฝงของการหลอมเหลวต่ำ
ของแข็งนั้นจะหลอมเหลวง่ายและมีจุดหลอมเหลวต่ำ
ในทางกลับกันของแข็งที่มีค่าความร้อนแฝงของการหลอมเหลวสูง ของแข็งนั้จะหลอมเหลวยาก มีแนวนัมว่าทำให้มีจุดหลอมเหลวสูง แต่ไม่เสมอไป พิจารณาความสัมพันธ์ระหว่างความร้อนแฝงของการหลอมเหลวกับจุดหลอมเหลวดังตารางต่อไปนี้
|
ธาตุ
|
ความร้อนแฝงของการหลอมเหลว
(Cal/g)
|
จุดหลอมเหลว
(oC)
|
ธาตุ
|
ความร้อนแฝงของการหลอมเหลว
(Cal/g)
|
จุดหลอมเหลว
(oC)
|
|
Aluminum
|
95
|
660
|
Iron
|
65
|
1,538
|
|
Beryllium
|
324
|
1,287
|
Lead
|
5.5
|
327
|
|
Chromium
|
79
|
1,907
|
Mercury
|
2.7
|
-38
|
|
Copper
|
49
|
1,084
|
Nickel
|
71
|
1,455
|
|
Gold
|
15
|
1,064
|
Platinum
|
24
|
1,768
|
|
Silver
|
26.5
|
961
|
Potassium
|
14.5
|
63
|
2. ความร้อนแฝงของการกลายเป็นไอ (latent heat of
vaporization , evaporization) คือความร้อนที่ทำให้ของเหลวขณะเดือดกลายเป็นไอโดยอุณหภูมิไม่เปลี่ยนแปลง เป็นค่าเฉพาะตัวของสารแต่ละชนิด ดังตาราง
|
สาร
|
Latent Heat of Evaporation,
kJ/mol
|
สาร
|
Latent Heat of Evaporation,
kJ/mol
|
|
CFC-12
(CCl2F2)
|
22
|
Water
|
40.68
|
|
R-13
(CClF3)
|
15.43
|
Bromine
|
193
|
|
Alcohol, ethyl
|
38.6
|
Carbon dioxide
|
574
|
|
Ammonia
|
23.35
|
Carbon tetrachloride
|
194
|
ค่าของความร้อนแฝงของการกลายเป็นไอ เป็นค่าที่บอกให้เราทราบว่าการระเหยของสารนั้น
ๆ จะต้องใช้ความร้อนมากหรือน้อย ความร้อนจะติดไปกับไอซึ่งระเหยไป ทำให้ส่วนที่เหลือจากการระเหยมีอุณหภูมิลดลง
ประสบการณ์ที่เราพบว่าเมื่อใช้น้ำลูบตัวจะรู้สึกว่าเย็น ก็อธิบายได้ด้วยหลักการนี้ คือเมื่อน้ำจากผิวหนังของเราระเหยไป จะดูดความร้อนจากผิวหนังของเราไปด้วย
ผิวหนังบริเวณที่มีการระเหยของน้ำจึงมีอุณหภูมิลดลง ทำให้รู้สึกว่าเย็นแต่จะเย็นอยู่เพียงครู่เดียว เพราะความร้อนจากส่วนอื่น ๆ ของร่างกายจะถ่ายเทมาทดแทน
ถ้าลูบผิวด้วยแอลกอฮอล์จะรู้สึกว่าเย็นกว่าน้ำ เพราะแอลกอฮอล์ระเหยได้เร็วกว่าจึงดูดความร้อนไปได้มากกว่าเมื่อเปรียบเทียบกับน้ำโดยใช้เวลาเท่า
ๆ กัน
ตู้เย็นและเครื่องทำความเย็นต่าง
ๆ ไม่ใช่เครื่องผลิตความเย็น ในทางพลังงานแล้วไม่มีพลังงานความเย็น มีแต่พลังงานความร้อน
ความเย็นเป็นเพียงความรู้สึกที่เกิดขึ้นเมื่อสัมผัสกับสิ่งที่มีพลังงานความร้อนอยู่น้อยกว่าตัวเรา
(อุณหภูมิต่ำกว่าตัวเรา)
ทำให้ความร้อนจากตัวเราถ่ายเทไปยังสิ่งที่มีอุณหภูมิต่ำกว่า เมื่อร่างกายเสียความร้อนอูณหภูมิก็ลดลงจึงรู้สึกว่าเย็น
การที่เครื่องปรับอากาศพ่นลมเย็นออกมาเกิดจาก ในระบบของเครื่องปรับอากาศมีสารจำพวก CFC
บรรจุอยู่ในท่อโลหะขดไปขดมา
เพื่อให้ได้ระยะทางมาก ๆ
ทำให้มีพื้นที่ผิวมาก
ท่อดังกล่าวนี้ปิดสนิท เครื่องรุ่นเก่าจะใช้สาร CFC-12
สูตรโมเลกุลคือ CFCl3 แต่ขณะนี้ให้เลิกใช้เพราะเมื่อรั่วไหลหรือปล่อยทิ้ง จะทำลายชั้นโอโซนในบรรยากาศ เครื่องรุ่นใหม่จะใช้สาร C-13 สูตรโมเลกุลคือ CF3Cl
สารนี้ทำลายโอโซนน้อยกว่า
ระบบของเครื่องปรับอากาศแบ่งออกเป็น 2
ส่วนคือ ส่วนที่ดูดความร้อนกับส่วนที่คายความร้อน
ส่วนที่ดูดความร้อนจะอยู่ภายในห้องหรือบริเวณที่ต้องการทำให้เย็น ส่วนคายความร้อนจะอยู่นอกห้อง ดังแผนภาพ
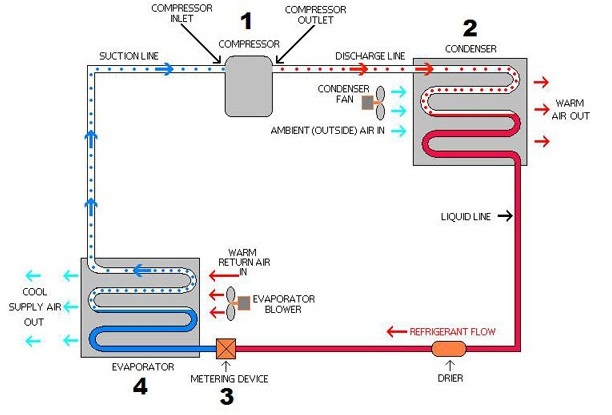
เมื่อเครื่องปรับอากาศทำงานจะพบว่าส่วนที่อยู่ในห้องจะพัดลมเย็นออกมา ในขณะที่ลมซึ่งพัดออกจากส่วนที่อยู่นอกห้องเป็นลมร้อน
อธิบายได้ว่าส่วนที่อยู่ในห้องจะดูดอากาศร้อนเข้าไปบริเวณหมายเลข 4 (ในแผนภาพ) ซึ่งมีท่อบรรจุสาร CFC หรือ
R-13 ขดไปขดมาอยู่เป็นจำนวนมาก
ความร้อนในอากาศที่ดูดเข้าไปสามารถผ่านเข้าไปในท่อได้เพราะเป็นโลหะนำความร้อนได้ดี ทำให้สาร CFC หรือ
R-13 เกิดการระเหยกลายเป็นไอ ความร้อนดังกล่าวติดไปกับไอ
อากาศที่ผ่านส่วนนี้ของเครื่องปรับอากาศจึงมีอุณหภูมิลดลงเมื่อเป่าออกมาจึงรู้สึกว่าเย็น
ไอของ CFC
หรือ
R-13 จะถูกส่งไปยังส่วนหมายเลข 2 (ตามแผนภาพ) ซึ่งอยู่นอกห้อง ทำให้เกิดการควบแน่นจึงคายความร้อน มีพัดลมเป่าเพื่อระบายความร้อนออกไป ลมที่พัดออกจากส่วนนี้จึงเป็นลมร้อน สาร CFC หรือ R-13
ที่ได้จากการควบแน่นจะถูกส่งกลับไปยังส่วนหมายเลข 4
เกิดการระเหยดูดความร้อนออกมาอีก.....หมุนเวียนซ้ำแล้วซ้ำเล่า ในที่สุดอุณหภูมิของอากาศในห้องก็จะลดลง แต่นอกห้องมีความร้อนอยู่มากมาย
พร้อมที่จะเดินทางเข้ามาในห้องอยู่ตลอดเวลา ฉะนั้นห้องปรับอากาศควรทำผนังห้องด้วยวัสดุที่เป็นฉนวนความร้อน และที่สำคัญคือไม่ควรเปิดประตูห้องทิ้งไว้
เพราะจะทำให้ความร้อนจากภายนอกเข้ามาในห้อง ไม่ใช่ความเย็นออกไปจากห้อง (คนชอบพูดว่าแอร์ออก ความจริงต้องพูดว่าความร้อนเข้า)
ตู้เย็นมีหลักการทำงานเหมือนครื่องปรับอากาศ
แต่ไม่ได้แยกส่วนสำหรับปล่อยความร้อนออกไปไว้นอกห้อง ระบบของตู้เย็นจะดูดความร้อนจากสิ่งต่าง ๆ
ในตู้เย็น ทำให้สาร CFC หรือ
R-13
เกิดการระเหย
จากนั้นถูกส่งไปควบแน่นบริเวณริมนอกหรือด้านหลังของตู้
จึงเป็นการดูดความร้อนที่อยู่ในตู้ออกมาปล่อยข้าง ๆ ตู้
สิ่งที่อยู่ภายในจึงมีอุณหภูมิต่ำ ดังรูป

การเปิดตู้เย็นแต่ละครั้งเป็นการเปิดให้ความร้อนจากภายนอกเข้าไปในตู้ ทำให้ตู้เย็นต้องทำงานหนักและสิ่งที่ต้องการแช่เย็นจะเย็นช้า การเปิดตู้เย็นทิ้งไว้นาน ๆ โดยหวังว่าจะทำให้อากาศในห้องเย็นลงเหมือนเปิดเครื่องปรับอากาศ
เป็นสิ่งที่เป็นไปไม่ได้เพราะตู้เย็นไม่มีระบบที่จะนำความร้อนจากในห้องไปปล่อยนอกห้อง
3. ความร้อนจำเพาะ (specific heat ,
s) หรือความจุความร้อน (Heat capacity ,
c) คือปริมาณความร้อนที่ทำให้สารใด
ๆ จำนวน 1.00 กรัม
มีอุณหภูมิสูงขึ้น 1.00 องศเซลเซียส
ปริมาณความร้อนชนิดนี้คิดได้จากสมการ

Q = ปริมาณความร้อน m = มวลของวัตถุ C,S = ความจุความรอ้นของวัตถุนั้น ๆ
T = อุณหภูมิที่เปลี่ยนไป
ตัวอย่างความร้อนจำเพาะของสารบางชนิด
|
Substance
|
C (J/g oC)
|
Substance
|
C (J/g oC)
|
|
Aluminum
|
0.902
|
Iron
|
0.450
|
|
Copper
|
0.385
|
Mercury
|
0.140
|
|
Gold
|
0.129
|
NaCl
|
0.864
|
|
Ice
|
2.03
|
Water
|
4.18
|
ความร้อนจำเพาะหรือความจุความร้อนของวัตถุ
มีผลต่อการเปลี่ยนแปลงอุณหภูมิของวัตถุเมื่อได้รับความร้อน ถ้าเป็นวัตถุต่างชนิดแต่มีมวลเท่ากัน ถ้าได้รับความร้อนจำนวนเท่ากัน วัตถุที่มีความจุความร้อนน้อยกว่า อุณหภูมิจะเพิ่มขึ้นมากกว่า เปรียบเสมือนภาชนะ 2
ใบ มีความจุไม่เท่ากัน แต่เติมน้ำซึ่งมีปริมาตรเท่ากันลงในภาชนะทั้ง 2
ใบ
ระดับน้ำในภาชนะที่มีความจุน้อยกว่า
จะสูงกว่าระดับน้ำในภาชนะที่มีความจุมากกว่า ดังรูป

ตัวอย่าง
ทองคำและน้ำชนิดละ 10 กรัม
มีอุณหภูมิ 25 oC เท่ากัน เมื่อต้องการทำให้อุณหภูมิเพิ่มชึ้น 5 oC จะต้องใช้ความร้อนอย่างละกี่จูล
(ใช้ค่าความร้อนจำเพราะจากตาราง)
กรณีของน้ำ ; Q = mcΔT
= (10 g)(4.18 J/g oC)( 5 oC )
= 209 J
กรณีของทองคำ ;
Q
= mcΔT
=
(10 g)(0.129 J/g oC)( 5 oC )
= 6.45 J
จากตัวอย่างหมายความว่า การทำใช้น้ำและทองคำซึ่งมีมวลเท่ากัน มีอุณหภูมิเพิ่มขึ้นเท่ากัน จะต้องให้ความร้อนแก่น้ำมากกว่าทองคำ (น้ำมีความจุความร้อนมากกว่าทองคำ)
หรือในอีกกรณีหนึ่งถ้ามีน้ำกับทองคำมวลเท่ากัน ให้ความร้อนเท่ากัน ทองคำจะมีอุณหภูมิสูงกว่าน้ำ เพราะทองคำจุความร้อนน้อยกว่าน้ำ กระทะ เตารีด ...
ควรทำด้วยโลหะที่จุความร้อนมากหรือน้อยจึงจะช่วยประหยัดพลังงาน เพราะเหตุใด
ในปฏิกิริยาเคมีหรือการเปลี่ยนแปลงต่าง ๆ อาจประกอบด้วยขั้นตอนย่อย ๆ หลายขั้นตอน มีทั้งขั้นตอนที่ดูดความร้อนและคายความร้อน ถ้านำความร้อนของทุกขั้นตอนรวมกัน (นำเครื่องหมาย + หรือ – มาด้วย) ค่าที่ได้เรียกว่าพลังงานของปฏิกิริยา เขียนแทนด้วย ΔHf (Heat of formation) หรือ ΔH อื่น ๆ เป็นไปตามการเปลี่ยนแปลงนั้น ๆ ΔH อาจมีค่าเป็นบวกหรือลบก็ได้ ถ้ามีค่าเป็นบวกหมายความว่าเป็นปฏิกิริยาแบบดูดความร้อน (emdothermic reaction) เกิดจากพลังงานส่วนที่ดูดเข้าไปมีปริมาณมากกว่าพลังงานส่วนที่คายออกมา ถ้ามีค่าเป็นลบหมายความว่าเป็นปกิกิริยาแบบคายความร้อน (exothermic
reaction) เกิดจากพลังงานส่วนที่คายออกมามีค่ามากกว่าพลังงานส่วนที่ดูดเข้าไป
แบบฝึกหัด
1. The temperature of 335 g of water
changed from 24.5oC to 26.4oC.
How much heat did this sample
absorb? c for water = 4.18 J/goC (ans. 2.66
kJ)
(เมื่อต้องการทำให้น้ำจำนวน 335 กรัม
อุณหภูมิ 24.5oC มีอุณหภูมิสูงขึ้นเป็น 26.4oC จะต้องให้ความร้อนเท่าไร
ถ้าความจุความร้อนของนน้ำ = 4.18 J/goC )
2. How much heat in kilojoules has to be removed from 225g
of water to lower its temperature from 25.0oC
to 10.0oC? (ans. –14.1 kJ)
(เมื่อต้องการทำให้น้ำ 225 กรัม
มีอุณหภูมิลดลงจาก 25.0oC
เหลือ 10.0o จะต้องดูดความร้อนออกมากี่กิโลจูล)
3. To bring 1.0 kg of water from 25oC to 99oC takes
how much heat input? (ans. 309 kJ)
(เมื่อต้องการทำให้น้ำ 1.0 กิโลกรัม
มีอุณหภูมิเพิ่มขึ้นจาก 25oC เป็น 99oC จะต้องให้ความร้อนกี่กิโลจูล)
4. An insulated cup contains 75.0g of water at 24.00oC. A 26.00g sample of
metal at 82.25oC is added. The
final temperature of the water
and metal is 28.34oC. What is the specific heat
of the metal?
(ans 0.971
J/goC )
(ถ้วยซึ่งมีสมบัติเป็นฉนวนความร้อนใบหนึ่ง
มีน้ำอยู่ 75.0 กรัม
อุณหภูมิ 24.00 oC จากนั้นนำโลหะชิ้นหนึ่งหนัก
26.00
กรัม อุณหภูมิ 82.25oC
ใส่ลงไป
ปรากฏว่าในที่สุดแล้วทั้งน้ำและโลหะมีอุณหภูมิ 28.34oC อยากทราบว่า
ความร้อนจำเพาะของโลหะเป็นเท่าไร)
5. A calorimeter has a heat capacity of 1265 J/oC.
A reaction causes the temperature of the calorimeter to
change from 22.34oC
to 25.12oC. How many joules of heat were released in this
process?
(ans. 3.52
kJ released )
(ถ้าแครอริมิเตอร์มีความจุความร้อน 1265 J/oC ถ้าปรากฏว่าเมื่อมีปฏิกิริยาเกิดขึ้นแล้ว ทำให้อุณหภูมิของแครอริ
มิเตอร์ เพิ่มขึ้นจาก
22.34oC เป็น 25.12oC
อยากทราบว่าปฏิกิริยาที่เกิดขชึ้นมีการคายพลังงานออกมากี่จูล)
* แคลอริมิเตอร์
เป็นอุปกรณ์ที่ใช้ทดลองเกี่ยวกับความร้อน
มีสมบัติเป็นฉนวนความร้อน
ป้องกันไม่ให้ความร้อน
จากด้านในและด้านนอกถ่ายเทถึงกัน
ลักษณะเดียวกับกระติกน้ำแข็ง คลิ้กดูรูป)
6. What is the specific heat of silicon if it takes 192J
to raise the temperature of 45.0g of Si by 6.0oC?
(ans. 0.71 J/goC) (ถ้าความร้อน 192 J ทำให้ซิลิคอน
45.0g
มีอุณหภูมิสูงขึ้น 6.0oC อยากทราบว่าความร้อน
จำเพาะของซิลิคอนเป็นเท่าไร)
7. Aqueous silver ion reacts with aqueous chloride ion to yield a white
precipitate of solid silver chloride.
10.0 mL of 1.00M
AgNO3 solution is added to 10.0mL
of 1.00 M NaCl solution at 25oC
in a calorimeter a
white precipitate of AgCl
forms and the temperature of the aqueous mixture increases to 32.6oC.
Assuming that the specific
heat of the aqueous mixture is 4.18 J/goC, that
the density of the mixture is
1.00 g/mL, and that the
calorimeter itself absorbs a negligible amount of heat, calculate the amount of
heat released in kJ/mol . (ans. -64 kJ/mol)
(สารละลาย AgNO3 ความเข้มข้น 1.00 M จำนวน 10.0 mL ผสมกับสารละลาย NaCl ความเข้มข้น
1.00 M
จำนวน
10.0 mL เช่นกันในแคลอริมิเตอร์ ซึ่งมีอุณหภูมิขณะเริ่มต้น 25
oC
ทำให้เกิดปฏิกิริยามีตะกอนสีขาว
ของ AgCl เกิดขึ้น
และอุณหภูมิเพิ่มขึ้นเป็น 32.6 oC ถ้าความร้อนจำเพาะของสารละลายคือ 4.18 J/goC และมี
ความหนาแน่น 1.00 g/mL โดยตัวของแคลอริมิเตอร์ดูดความร้อนได้น้อยมาก จงคำนวณหาพลังงานความร้อนที่
คายออกมา ในหน่วย
kJ/mol)
8. that Coca Cola has the same specific heat as water ( 4.18
J/goC), calculate the amount of heat in kJ
transferred when one can (
about 350g) is cooled from 25oC
to 3oC . (ans.
32.2 kJ of heat was
transferred)
(ถ้าโคคา โคลา มีความร้อนจำเพาะเท่ากับน้ำ คือ 4.18
J/goC
อยากทราบว่าถ้าต้องการแช่เย็นโคคา โคลา
1
กระป๋อง (มีมวล
350 กรัม) เพื่อทำให้อุณหภูมิลดลงจาก 25oC เป็น 3oC จะต้องดูดความร้อนออกมากี่ kJ)
9. What is the specific heat of lead if it takes 96J to
raise the temperature of a 75 g block by 10oC?
(ans. 0.128
J/gºC) (ตะกั่วก้อนหนึ่งมีมวล 75
กรัม ได้รับความร้อน 96 J
ทำให้อุณหภูมิเพิ่มขึ้น 10 oC
อยาก
ทราบว่าความรอ้นจำเพาะของตะกั่วเป็นเท่าไร)
10. When 25
mL of 1.0 M H2SO4 is added to 50 mL of 1.0
M NaOH at 25oC in a calorimeter, the
temperature of the
aqueous solution increases to 33.9 oC. Assuming
that the specific heat of the
solution is 4.18 J/g°C, that its density is 1.00 g/mL, and that the calorimeter itself absorbs a negligible
amount of heat, calculate
the amount of heat released for the reaction. (ans. 2.79
kJ heat released)
(ณ อุณหภูมิ 25 oC ทดลองผสมสารละลาย H2SO4 ความเช้มข้น 1.0 M จำนวน
25 mL กับสารละลาย
NaOH ความเข้มข้น 1.0 M จำนวน 50
mL เข้าด้วยกัน
ในแคลอริมิเตอร์
พบว่าปฏิกิริยาทำให้อุณหภูมิ
เพิ่มขึ้นเป็น 33.9 oC ถ้าความร้อนจำเพาะของสารละลายคือ 4.18 J/g°C และมีความหนาแน่น 1.00 g/mL
และแคลอริมิเตอร์ดูดความร้อนไปน้อยมาก
จงคำนวณหาปริมาณความร้อนที่ปฏิกิริยาปล่อยออกมา)
11. Titanium metal is used as a structural material in many high-tech
applications such as jet engines. What
is the specific heat of
titanium in J/g°C if it takes 89.7 J to raise the
temperature of a 33.0g block by
5.20°C? What is the molar
heat capacity of titanium in J/mol °C? (ans.
25.0 J/molºC)
(โลหะไททาเนียม ใช้เป็นส่วนประกอบของเครื่องมือเครื่องใช้จำพวกเทคโนโลยีสูง เช่น
เครื่องยนต์ของเครื่องบินไอ
พ่น ถ้าพบว่าโลหะนี้ 33.0
g
เมื่อได้รับความร้อน 99.7 J แล้ว ทำให้อุณหภูมิสูงขึ้น 5.20
oC
อยากทราบว่า
ความร้อนจำเพาะมีค่ากี่ J/g°C )
12. Sodium metal is sometimes used as a cooling agent in heat exchange units
because of its relatively
high molar heat capacity
of 28.2 J/mol°C. What is the specific heat of sodium in
J/g°C?
(ans. 1.23
J/gºC).
(ในบางครั้งใช้โลหะโซเดียมเป็นตัวระบายความร้อนของระบบจากแหล่งกำเนิดความร้อน เนื่องจากมีความจุความ
ร้อนมากคือ = 28.2 J/mol°C อยากทราบว่าความร้อนจำเพาะของโลหะโซเดียมเป็นกี่ J/g°C )
13. A 15.75 g piece of iron absorbs 1086.75 joules
of heat energy, and its temperature changes from 25°C
to 175°C. Calculate the specific heat capacity of iron.
(เหล็กชิ้นหนึ่งมีมวล 15.75 g
เมื่อได้รับความร้อน 1086.75 จูล ทำให้อุณหภูมิเพิ่มขึ้นจาก 25°C
เป็น 175°C
จงคำนวณหาความจุความร้อนหรือความร้อนจำเพาะของเหล็ก)
14. How many joules of heat are needed to raise the temperature of 10.0 g of aluminum from 22°C to 55°C,
if the specific heat of
aluminum is 0.90 J/g°C?
(ถ้าความร้อนจำเพาะของอลูมิเนียมคือ 0.90 J/g°C อยากทราบว่าเมื่อต้องการทำให้อลูมิเนียม 10
กรัม มี
อุณหภูมิเพิ่มขึ้นจาก 22°C เป็น 55°C จะต้องใช้ความร้อนกี่จูล)
15. Calculate the specific heat capacity of a piece of wood if 1500.0
g of the wood absorbs 67,500 joules of
heat, and its temperature
changes from 32°C to 57°C.
(
ไม้ชิ้นหนึ่งมีมวล 1500.0 g เมื่อได้รับความร้อน 67,500 จูล
ปรากฎว่าอุณหภูมิเพิ่มขึ้นจาก 32°C
เป็น 57°C
อยากทราบว่าความจุความร้อนหรือความร้อนจำเพาะของไม้เป็นเท่าไร )
16. 100.0 g of 4.0°C water is heated until its temperature is 37°C. If the specific
heat of water is 4.18 J/g°C,
calculate the amount of
heat energy needed to cause this rise in temperature.
(น้ำ 100
กร้ม อุณหภูมิ 4.0 oC
ได้รับความร้อนจนอุณหภูมิเพิ่มขึ้นเป็น
37°C
อยากทราบว่าปริมาณความร้อน
ที่น้ำได้รับเป็นเท่าไร ถ้าความร้อยจำเพาะของน้ำคือ 4.18 J/g°C )
17. 25.0 g of mercury is heated from 25°C to 155°C,
and absorbs 455 joules of heat in the process.
Calculate the specific heat
capacity of mercury.
(ปรอท
25.0 กรัม เมื่อได้รับความร้อน 455
จูล
ทำให้อุณหภูมิเพิ่มขึ้นจาก 25 °C
เป็น 155 °C
จงคำนวณหา
ความร้อนจำเพาะหรือความจุความร้อนของปรอท )
18. What is the specific heat capacity of silver metal if 55.00
g of the metal absorbs 47.3J of heat and the
temperature rises 15.0°C?
(โลหะเงินมีมวล 55.00
กรัม เมื่อได้รับความร้อน 47.3
จูล
ปรากฏว่าอุณหภูมิเพิ่มขึ้น
15.0 oC อยากทราบบว่า
ความร้อนจำเพาะหรือความจุความร้อนของโลหะเงินเป็นเท่าไร)
19. What mass of water will change
its temperature by 3 0C when 525
J of heat is added to it? The specific
heat of water is 4.18 J/g 0C
(น้ำจำนวนหนึ่งเมื่อได้รับความร้อน
525 J
ปรากฏว่าอุณหภูเปลี้ยนไป 3 0C
อยากทราบว่าน้ำดังกล่าวมีมวลเท่าไร
ถ้าความร้อนจำเพาะของน้ำคือ 4.18 J/g 0C )
20. A 0.3 kg piece of copper is heated and fashioned into
a bracelet. The amount of energy
transferred by
heat to the copper is 66,300 J. If the specific
heat of copper is 390 J/g 0C,
what Is the change of the
copper's temperature?
(ทองแดงชิ้นหนึ่งมีมวล 0.3
กรัม นำไปทำเป็นสร้อยข้อมือ กระบวนการดังกล่าวต้องใช้ความร้อน 66,300 J
อยากทราบว่าอุณหภูมิของทองแดงจะเปลี่ยนไปเท่าไร
ถ้าความรุความร้อนหรือความร้อนจำเพาะของทองแดงคือ
390 J/g 0C)
รูปภาพที่เกี่ยวข้อง

Size : 21.31 KBs
Upload : 2014-08-09 05:36:43
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|